ТРЕХЦЕНТРОВЫЕ ДВУХЭЛЕКТРОННЫЕ СВЯЗИ
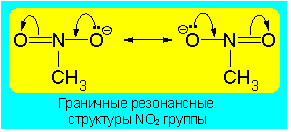
Трехцентровая связь является простейшей из многоцентровых связей, при ее образовании три атома обобществляют одну электронную пару. Ничего сверхъестественного здесь нет. Всем хорошо известна металлическая связь, связывающая атомы металлов. В этом случае очень большое число N атомов металла обобществляет свои электроны, поэтому металлическую связь можно назвать N-центровой N-электронной связью. Другим широко известным примером является ароматическая связь, существующая в молекулах ароматических молекул, например в бензоле. Ароматическая связь в молекуле бензола является шестицентровой шестиэлектронной связью. Правда чаще всего при описании ароматичности говорят о p-делокализации электронов, а связи называют "полуторными". И последний пример - нитрогруппа. В даном случае также имеет место делокализация p-электронов, в результате чего происходит делокализация отрицательного заряда по обоим атомам кислорода. Для описания такой делокализации оычно используется теория резонанса. т.е. истинное строение молеклы передают с помощью набора "граничных структур", для нитро-группы их две:
Нетрудно сообразить, что в данном случае мы имеем трехцентровую четырехэлектронную связь.
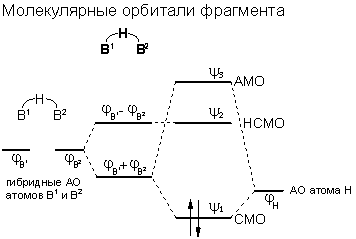
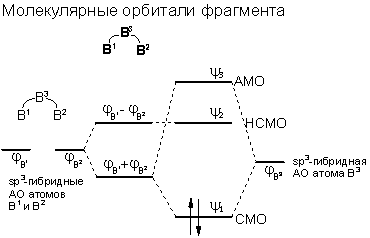
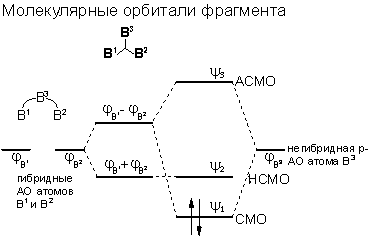
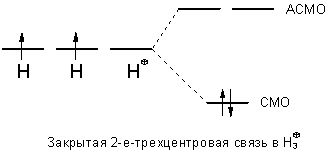
Согласно современной теории молекулярных орбиталей трехцентровые связи описывают посредством перекрывания трех атомных орбиталей, в результате чего образуются три молекулярные орбитали, например, для катиона Н3+:
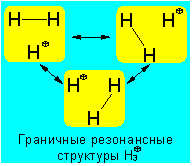
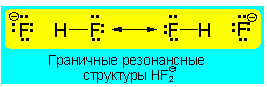
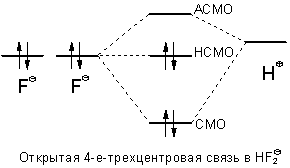
Трехцентровая четырехэлектродная связь присутствует в анионе HF2-:
Аналогичная картина наблюдается также для аниона I3-:
При этом одна орбиталь всегда является связывающей, и одна - антисвязывающей. Третья молекулярная орбиталь может быть слабо связывающей, слабо антисвязывающей или несвязывающей. Типичными примерами молекул с трехцентровыми связями являются ион H3+, диборан (B2H6), гидродифторид- (FHF-) или нитрит-анион (NO2-). В случае трех- или многоцентровых связей говорят также о делокализации связывающих электронов. В отличие от них, двухцентровые - нормальные ковалентные связи - а также неподеленные электронные пары обозначаются как локализованные.
Открытые и закрытые трехцентровые связи
Различают открытые трехцентровые связи как например в ионе FHF- и закрытые трехцентровые связи, как например в ионе H3+. В первом случае орбитали двух из трех атомов практически не перекрываются (орбитали двух крайних атомов фтора), а во втором случае имеется попарное перекрывание всех трех атомных орбиталей - образуется цикл. За счет сближения крайних атомов открытая трехцентровая связь может переходить в закрытую трехцентровую связь. Тогда как открытые трехцентровые связи могут содержать до четырех электронов - два из них располагаются на несвязывающей орбитали, закрытая трехцентровая связь стабильна только в том случае, если на молекулярных орбиталях размещаются максимум два электрона.
3-Центровая 2-электронная связь и 3-центровая-4-электронная связь
В литературе часто встречаются понятия 3-центровая-2-электронная связь или 3-центровая-4-электронная связь. Эти понятия отображают, сколько электронов в данной молекуле размещены на трех молекулярных орбиталях, образовавшихся в результате трехцентрового взаимодействия. Однако поскольку только одна из трех молекулярных орбиталей может рассматриваться как связывающая и на орбитали могут быть размещены максимум два электрона, широко используется только понятие 3-центровой-2-электонной связи. В случае четырех электронов, занимается также несвязывающая орбиталь. Поскольку орбиталь обладает значимым вкладом (коэффициентами) только на двух внешних атомах, эти электроны сходны с неподеленными парами электронов этих атомов. В соответствии с этим связывание в этих 3-центровых-4-электронных связях могут быть представлены соответственно двумя мезомерными граничными структурами. В данном случае на одном из двух крайних атомов расположена одна неподеленная электронная пара, направленная в сторону центрального атома, а от другого атома исходит связь с центральным атомом (граничная структура связь/нет свзи) (см. ион HF2-).Для адекватного представления трехцентровой связи с помощью формул Льюиса необходимо по меньшей мере две мезомерные граничные структуры. Наряду с ними укоренились специальные символы, которые однако не стали общепринятыми, поскольку их зачастую можно перепутать со скелетными формулами.
Трехцентровые связи в гидридах бора
Концепция трехцентровых двухэлектронных связей возникла и получила свое основное развитие в ходе исследования соединений бора, в частности бороводородов. Известно, что простейший бороводород (боран) имеет формуулу В2Н6, а не ВН3, как это можно было бы ожидать, на основании того непреложного факта, что у атома бора имеется три валентных электрона. Для образования молекулы В2Н6 явно не хватает двух электронов, в связи с чем эту молекулу, и ей подобные, окрестили "электронодефицитными". На самом деле, никакого дефицита электронов нет, атомам этих молекул вполне "хватает" имеющихся валентных электронов для образования молекул. Правда на разработку методов описания строения этих молекул пришлось затратить много труда. Большой вклад в решение этой проблемы внес WILLIAM N. LIPSCOMB, за что ему была присуждена Нобелевская премия по химии 1976 г. В боранах имеются три типа трехцентровых двухэлектронных связей: открытые трехцентровые двухэлектронные связи НВН и ВВВ и закрытые трехцентровые двухэлектронные связи ВВВ: