ВИЛЬЯМ Н. ЛИПСКОМ
Гарвардский Университет, Кембридж, Массачусетс, США.
В этом году, 1976, Нобелевская премия по химии была присуждена за исследование в области неорганической химии, в частности химии боранов. Должен сказать, что я очень польщен и глубоко признателен. Мое обращение к этой области, как и все мои исследования, было обусловлено поиском взаимосвязи химического поведения молекул и их трехмерной геометрической и электронной структуры. Ранее проведенные работы по молекулярной структуре боранов методом дифракции рентгеновских лучей привели к созданию рациональной базы для теории химической связи, отличной от той, что является типичной для химии углерода, и вылилось в понимание красивой полиэдрической структуры этих соединений. Эти принципы, усвоенные химиками-синтетиками, помогли наработать большой материал в неизвестной к тому времени области химии, который сделал реальными предположения о том, что бор, сосед углерода по Периодической таблице, в действительности имеет сложную химию. В эти почти тридцать лет как теоретические, так и экспериментальные методы были использованы нами и другими исследователями в области неорганической, физической, органической и биологической химии. Например, эти области включают в себя технику низкотемпературной дифракции рентгеновских лучей и теоретические исследования многоцентровых химических связей, включая как локализованные, так и делокализованные молекулярные орбитали. Наиболее ранним примером является расширенный метод Хюккеля, изначально разработанный для исследования боранов, и до настоящего времени являющийся одним из наиболее широко применяемых приближенных методов теоретического изучения химических связей в сложных молекулах. Более солидно обоснованные теории в настоящее время используются моими учениками для изучения ферментативного катализа реакции, детали которого основаны на трехмерных структурах, полученных методами дифракции рентгеновских лучей. Кроме объяснения частных проблем, эти разработки могут способствовать переопределению областей химии, и тем самым расширить кругозор химиков. Наши исследования боранов и родственных им молекул находятся на пересечении областей неорганической, экспериментальной физической, теоретической и органической химии, и включают в себя приложения в биохимии. Проще говоря, областью исследований является изучение взаимосвязи молекулярной структуры и функции.
БОРАНЫ, И РАННИЕ ИССЛЕДОВАНИЯ ИХ СТРОЕНИЯ
Последующие низкотемпературные исследования монокристаллов этих летучих и нестабильных боранов были небезопасны. По необходимости мы изучили вакуумные технологии. К счастью, мы не понесли серьезного ущерба в результате нескольких взрывов, произошедших в результате поломок вакуумной системы. Я успокоился, когда однажды, при встрече с Расселом Гримсом в клинике Кембриджа после одного из таких взрывов доктор сказал мне: “Луис Физер присылает мне более интересные случаи, чем вы”. У меня в офисе было даже духовое ружье, которое я, или мой младший сын, использовали в ряде случаев для разрушения поломанной вакуумной системы с безопасного расстояния. У нас также были химические сюрпризы, например, когда мы обнаружили, что предполагаемый гидрид B8 является B9H15.21 Единственным результатом проведенного нами химического анализа этого соединения было число атомов бора и водорода на карте электронной плотности, которая была рассчитана в те дни на основании грубой визуальной оценки интенсивности дифракционных максимумов на пленках.
ТРЕХЦЕНТРОВЫЕ СВЯЗИ МЕЖДУ АТОМАМИ БОРА
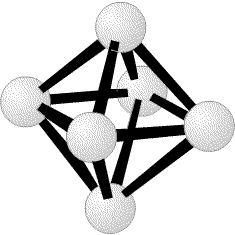
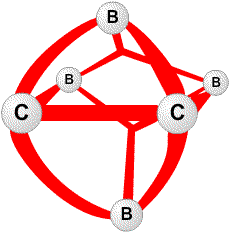
 (рис. 2). Лонге-Хиггинс23 также, независимо от нас, сформировал первоначальное молекулярно-орбитальное описание, очень похожее на наше. Одним из наиболее простых следствий этих исследований было то, что электронодефицитные молекулы, определяемые как молекулы, имеющие большее число молекулярных орбиталей, чем электронов, в действительности не являются электронодефицитными. Под этим неочевидным утверждением я подразумеваю то, что трехцентровые двухэлектронные связи делают возможным простое описание этих молекул и ионов как частиц с заполненными орбиталями. Заполненные молекулярные орбитали позже были распространены на закрытые полиэдрические соединения BnHn, для всех значений n от 5 до 24, все из которых имеют формальный заряд -2, даже если гипотетический B4H4 нейтрален. Действительно, все известные экспериментально ионы, с 6< n <12, имеют заряд -2. так же как B6H62
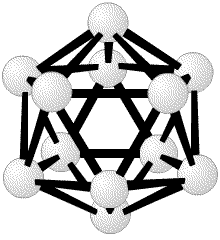
(рис. 2). Лонге-Хиггинс23 также, независимо от нас, сформировал первоначальное молекулярно-орбитальное описание, очень похожее на наше. Одним из наиболее простых следствий этих исследований было то, что электронодефицитные молекулы, определяемые как молекулы, имеющие большее число молекулярных орбиталей, чем электронов, в действительности не являются электронодефицитными. Под этим неочевидным утверждением я подразумеваю то, что трехцентровые двухэлектронные связи делают возможным простое описание этих молекул и ионов как частиц с заполненными орбиталями. Заполненные молекулярные орбитали позже были распространены на закрытые полиэдрические соединения BnHn, для всех значений n от 5 до 24, все из которых имеют формальный заряд -2, даже если гипотетический B4H4 нейтрален. Действительно, все известные экспериментально ионы, с 6< n <12, имеют заряд -2. так же как B6H62 (рис. 1) и B12H122
(рис. 1) и B12H122 (рис. 2), эти полиэдры с 5< n <10 показаны на рис. 9. Изоэлектронный ряд C2Bn-2Hn известен с5< n <12. Уравнения баланса атомов, орбиталей и электронов, сформулированные нами в статье 1954 г., позволили предсказать множество новых химических веществ. Простая форма этих правил сформулирована для нейтральных гидридов формулы BрHp+q в которых каждый атом бора имеет по меньшей мере один терминальный атом водорода. Обозначим число мостиков BHB как s, число трехцентровых связей BBB как t, число двухцентровых связей BB как y и число дополнительных терминальных атомов водорода каждого фрагмента BH как x. Тогда
(рис. 2), эти полиэдры с 5< n <10 показаны на рис. 9. Изоэлектронный ряд C2Bn-2Hn известен с5< n <12. Уравнения баланса атомов, орбиталей и электронов, сформулированные нами в статье 1954 г., позволили предсказать множество новых химических веществ. Простая форма этих правил сформулирована для нейтральных гидридов формулы BрHp+q в которых каждый атом бора имеет по меньшей мере один терминальный атом водорода. Обозначим число мостиков BHB как s, число трехцентровых связей BBB как t, число двухцентровых связей BB как y и число дополнительных терминальных атомов водорода каждого фрагмента BH как x. Тогда s + x = q
s + t = p
p = t + y + q/2
NBHB + NBH(немост) = NH - NB
NBHB + NBBB = NB
NB = NBBB + NBB + (NH - NB)/2
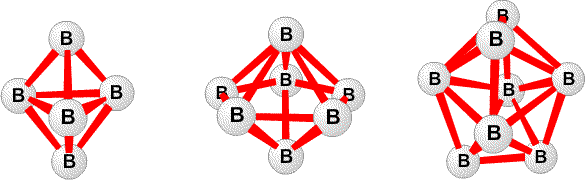
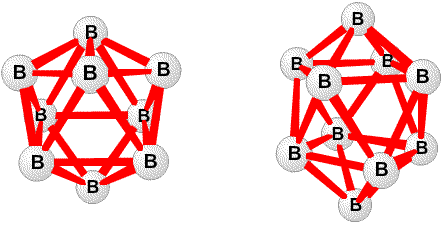
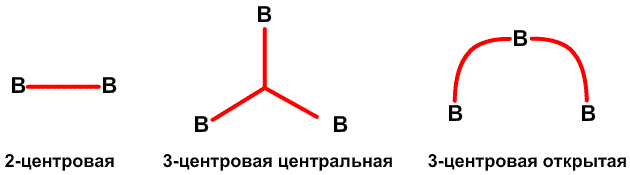
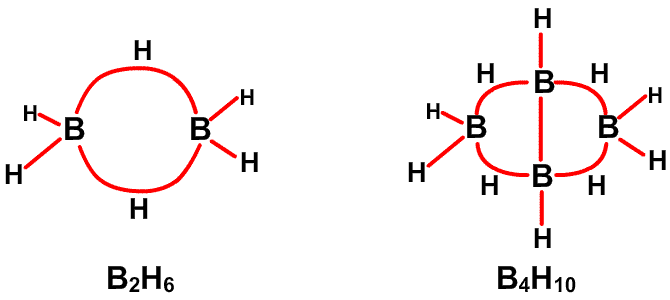
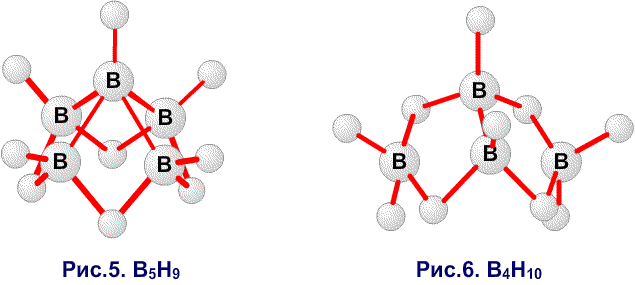
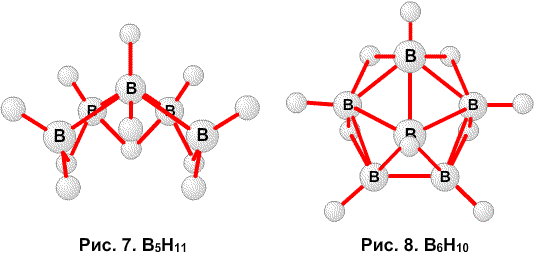
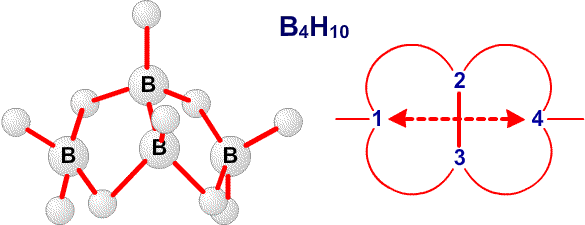
Рис. 12. Связи в B4H10.
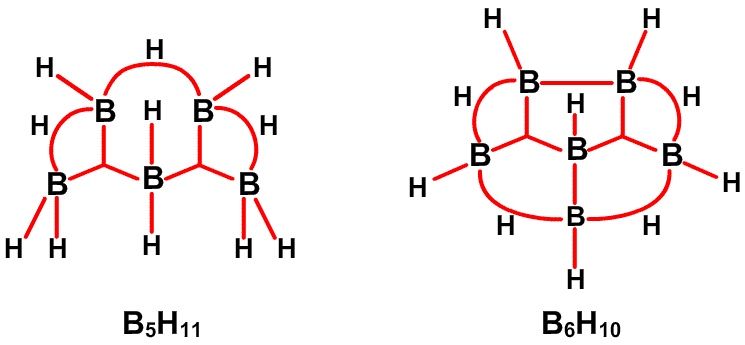
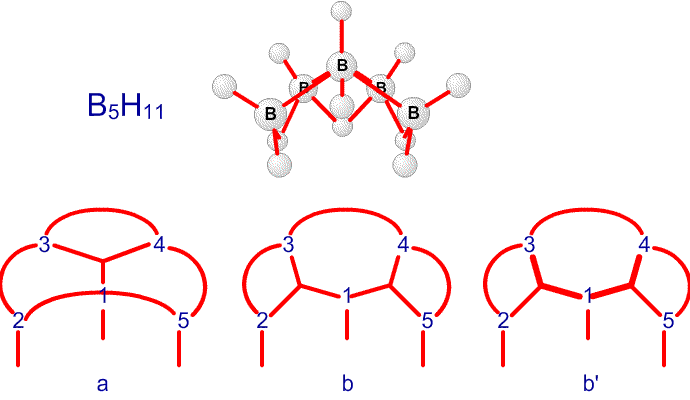
Рис. 13. Связи в B5H11.
Рис. 14. Связи в B6H10.
Теория трехцентровых связей была развита далее в течение последующих 22 лет. 24 Я понимал, что правила валентности, подразумевающие существование огромного числа соединений бора, позволяют делать самые смелые предположения, некоторые из которых были действительно подтверждены экспериментально. Дикерсон 25 и я формализовали мой интуитивный подход в теорию соединения различных связывающих фрагментов в рамках трехцентрового описания. Также были введены геометрические напряжения с целью избежать чрезмерной скученности атомов водорода и сохранить известные валентные углы атома бора в боранах.26. Совсем недавно, Эпштейн 27 и я переформулировали топологию, используя центральные трехцентровые связи BBB, для исключения открытых трехцентровых связей BBB. Недавняя работа по локализованным молекулярным орбиталям, которая привела к ограничению использования открытых трехцентровых связей, проиллюстрирована на примере связей BCB в последней части настоящей рукописи.
МОЛЕКУЛЯРНО-ОРБИТАЛЬНОЕ ИЗУЧЕНИЕ БОРАНОВ
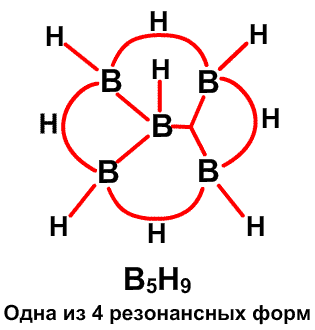
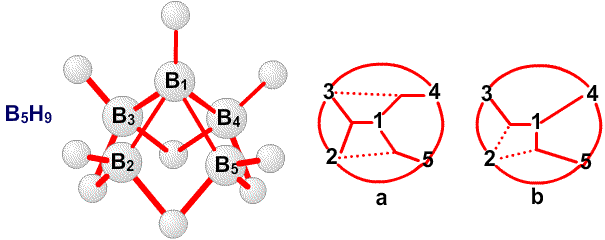
Молекулярные орбитали более подходят для описания валентных структур полиэдрических молекул и ионов, а также более компактных полиэдрических фрагментов. Два простых примера будет достаточно. В B5H9 имеется три пары электронов в каркасе атомов бора, который имеет симметрию четвертого порядка. Химические связи наилучшим образом описываются без привлечения резонанса, простым набором s- и p-молекулярных орбиталей 22, 24, 28 (Рис. 17). Эти орбитали подобны связывающим орбиталям, например, между плоским четырехчленным циклобутадиеном (C4H4) и CH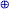 , размещенным вдоль оси четвертого порядка, образующими карбониевый ион C5H5
, размещенным вдоль оси четвертого порядка, образующими карбониевый ион C5H5 . Аналогичная s, p-ситуация наблюдается28 в том случае, если BH фрагмент удалить из икосаэдрической молекулы B12H122
. Аналогичная s, p-ситуация наблюдается28 в том случае, если BH фрагмент удалить из икосаэдрической молекулы B12H122 , оставив B11H112
, оставив B11H112 , в котором имеется пять атомных орбиталей, содержащих четыре электрона (рис. 18). Этот набор из пяти орбиталей дает s, p-молекулярные орбитали, которые могут связываться с подобным набором s, p-орбиталей другого атома или группы атомов, поставляющих дополнительно два электрона. Я предположил, мысленно, добавление H3
, в котором имеется пять атомных орбиталей, содержащих четыре электрона (рис. 18). Этот набор из пяти орбиталей дает s, p-молекулярные орбитали, которые могут связываться с подобным набором s, p-орбиталей другого атома или группы атомов, поставляющих дополнительно два электрона. Я предположил, мысленно, добавление H3 , чтобы предсказать B11H14
, чтобы предсказать B11H14 , например. Впрочем, с учетом сходства этого набора орбиталей набору орбиталей в C5H5, который, как известно, образует ферроцен (C5H5)2Fe, я не пошел настолько далеко, чтобы предположить возможность присоединения этого B11H112
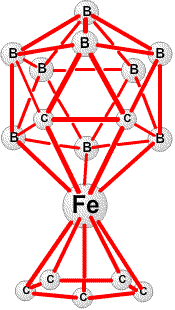
, например. Впрочем, с учетом сходства этого набора орбиталей набору орбиталей в C5H5, который, как известно, образует ферроцен (C5H5)2Fe, я не пошел настолько далеко, чтобы предположить возможность присоединения этого B11H112 фрагмента к переходному металлу. Позднее, Hawthorne сделал это, используя эти идеи в качестве исходной точки, и на этой основе получил большое семейство металлоборанов и металлокарборанов 29 (рис. 19). В начале 1960-х, когда нам стали доступны большие вычислительные мощности, Роальд Хофман и Лоуренс Лор независимо друг от друга в моей исследовательской группе запрограммировали расширенный метод Хюккеля.
фрагмента к переходному металлу. Позднее, Hawthorne сделал это, используя эти идеи в качестве исходной точки, и на этой основе получил большое семейство металлоборанов и металлокарборанов 29 (рис. 19). В начале 1960-х, когда нам стали доступны большие вычислительные мощности, Роальд Хофман и Лоуренс Лор независимо друг от друга в моей исследовательской группе запрограммировали расширенный метод Хюккеля.
 -Молекулярные орбитали являются пятицентровыми, а каждый из
-Молекулярные орбитали являются пятицентровыми, а каждый из 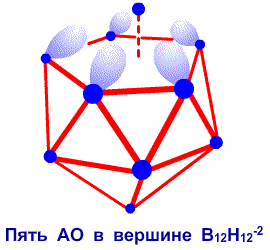
 , или C2B10H12, остаются пять атомных орбиталей, содержащих четыре электрона. Эти пять атомных орбиталей образуют
, или C2B10H12, остаются пять атомных орбиталей, содержащих четыре электрона. Эти пять атомных орбиталей образуют  .
.
Его первым применением было в химии бора,30 где, в особенности в карборанах (соединениях бора, углерода и водорода), распределение заряда предсказывает центры электрофильного и нуклеофильного замещения. Одно из довольно простых правил, которое было установлено, заключается в том, что нуклеофильная атака в полиэдрическом карборане происходит по атому бора, ближайшему к атому углерода, тогда как электрофильная атака преимущественно осуществляется по атому бора, наиболее удаленному от атома углерода. Экспериментальное исследование боранов и карборанов, в которых один или большее число атомов водорода замещены на галоген или амино-группу, подтверждают эти предсказания. Расширенный метод Хюккеля со временем стал наиболее широко используемой программой для изучения молекулярной теории и реакций сложных органических и неорганических молекул. Например, правила Вудворда-Хофмана и аналогичные орбитальные теории, были проверены их создателями31 с использованием этой теории. Тогда я думал, что прогресс в установлении строения новых полиборанов, а также замещенных боранов и карборанов, сильно ускорится, если начнется использование 11 ЯМР-спектроскопии, вместо рентгеноструктурного анализа. Одним из подходов был эмпирический32, тогда как другие были чисто теоретическими. Этот последний подход требует развития теории для достаточно точных расчетов химических сдвигов 11 на основании основных принципов квантовой механики.33 Эта теория, сопряженный метод Хартри-Фока для молекулы в магнитном или электрическом поле, дает молекулярные константы с точностью до нескольких процентов 34 для большинства двухатомных молекул. Поразительным результатом было предсказание парамагнитной природы двухатомной молекулы BH.35 Однако, применение этого метода к сложным боранам остается делом будущего, даже после 13 лет усилий. Хотя мы понимаем некоторые составляющие химического сдвига, диамагнитный и большой не зависящий от температуры парамагнитный эффект, использование этого метода для определения структуры сложных полиборанов до сих пор достаточно ограниченно. Эти программы дают точные молекулярные орбитали самосогласованного поля, которые были исследованы в других областях химии, так же как и в химии боранов и карборанов. Одним из примеров является первый точный расчет барьера внутреннего вращения в молекуле этана36. В настоящее время мои ученики и я начали изучение пространства между расширенным методом Хюккеля и теорией самосогласованного поля. Постепенно 37,38 мы пришли к выводу, что молекулярноорбитальная теория 39, в несколько расширенном варианте, оказывается приложимой к большим полиборанам и другим молекулам, и имеет по существу точность метода самосогласованного поля. Методы молекулярных орбиталей, которые не выходят за рамки симметрии орбиталей, имеют тенденцию превращать рассмотрение каждой молекулы в особый случай. В связи с этим, несколько лет тому назад мы начали исследовать связи между этими симметричными орбиталями и трехцентровыми связями предыдущего раздела.
ЛОКАЛИЗОВАННЫЕ МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
Как правило, молекулярные орбитали классифицируются в соответствии с их типом симметрии. Однако можно составить линейные комбинации молекулярных орбиталей различной симметрии таким образом, что суммарная электронная плотность молекулы останется неизменной. Наиболее популярными методами являются методы Эдминстона и Рюденберга40, в которых максимизируюся интегралы: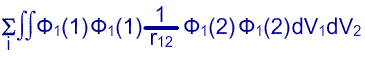
 .
.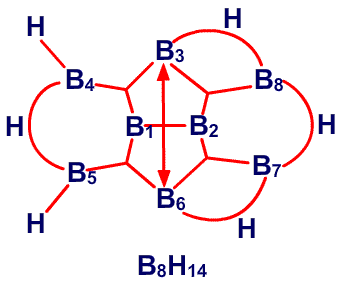
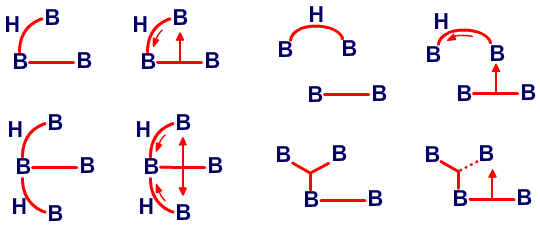
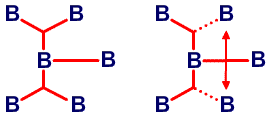
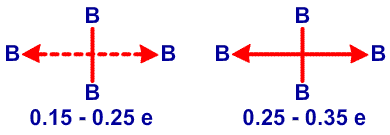
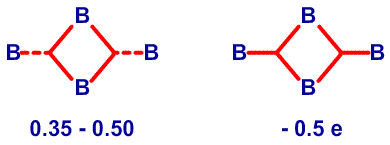
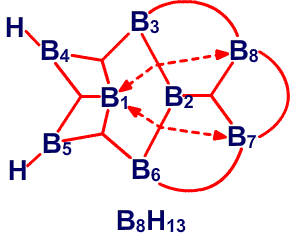
 и предсказанную структуру B8H14, соответственно45 (Рис. 24 и 25). Из этих примеров я вычленил некоторые типичные виды донорного эффекта одинарной связи, и добавил оттягивание электронов или смещение атомов водорода, на рис. 26. Эти и аналогичные валентные диаграммы могут быть полезными в понимании внутримолекулярных напряжений и механизмов реакций. Новый тип связи, который концептуально приписывается этим молекулам, описывается как частично трехцентровые связи.46 Их простейшее объяснение заключается в замене пары резонансных структур одной валентной структурой (рис. 27). Частичное участие орбиталей, обозначаемой пунктирными линиями, увеличивает кажущееся число связей у атома бора сверх обычных для элемента второго периода периодической таблицы четырех. Однако принцип Паули тем самым не нарушается, поскольку в образовании частичной связи атомная орбиталь принимает участие не целиком. Фактически, сами локализованные молекулярные орбитали выводятся из волновых функций, для которых были строго введены принципы исключения. Использование частичных связей для снижения числа резонансных гибридов, зачастую до одной преобладающей структуры, не ограничивается боранами и их производными. Наши достаточно обширные исследования связей между атомами, отличными от бора, показали, что эти простейшие локализованные молекулярные орбитали могут быть информативной и полезной альтернативой для более обычной ковалентной валентной связи и молекулярно-орбитальным описаниям в других частях периодической таблицы. Очень простой пример, карбоксилат анион,47 показанный на рис. 28. Связи атома B2 в 4,5-C2B4H8 предпочтительно изображать в виде частичных связей48, а не в виде резонансного гибрида одинарной и одинарной и центральной трехцентровой связи, и поэтому являются более предпочтительными, чем открытая трехцентровая связь (рис. 29). Кроме того, связывание двух атомов углерода в этом карборане одинарной связью и трехцентровой связью в боранах не обнаружено, и, в частности, не происходит в B6H10, который изоэлектронен 4,5-C2B4H8.
и предсказанную структуру B8H14, соответственно45 (Рис. 24 и 25). Из этих примеров я вычленил некоторые типичные виды донорного эффекта одинарной связи, и добавил оттягивание электронов или смещение атомов водорода, на рис. 26. Эти и аналогичные валентные диаграммы могут быть полезными в понимании внутримолекулярных напряжений и механизмов реакций. Новый тип связи, который концептуально приписывается этим молекулам, описывается как частично трехцентровые связи.46 Их простейшее объяснение заключается в замене пары резонансных структур одной валентной структурой (рис. 27). Частичное участие орбиталей, обозначаемой пунктирными линиями, увеличивает кажущееся число связей у атома бора сверх обычных для элемента второго периода периодической таблицы четырех. Однако принцип Паули тем самым не нарушается, поскольку в образовании частичной связи атомная орбиталь принимает участие не целиком. Фактически, сами локализованные молекулярные орбитали выводятся из волновых функций, для которых были строго введены принципы исключения. Использование частичных связей для снижения числа резонансных гибридов, зачастую до одной преобладающей структуры, не ограничивается боранами и их производными. Наши достаточно обширные исследования связей между атомами, отличными от бора, показали, что эти простейшие локализованные молекулярные орбитали могут быть информативной и полезной альтернативой для более обычной ковалентной валентной связи и молекулярно-орбитальным описаниям в других частях периодической таблицы. Очень простой пример, карбоксилат анион,47 показанный на рис. 28. Связи атома B2 в 4,5-C2B4H8 предпочтительно изображать в виде частичных связей48, а не в виде резонансного гибрида одинарной и одинарной и центральной трехцентровой связи, и поэтому являются более предпочтительными, чем открытая трехцентровая связь (рис. 29). Кроме того, связывание двух атомов углерода в этом карборане одинарной связью и трехцентровой связью в боранах не обнаружено, и, в частности, не происходит в B6H10, который изоэлектронен 4,5-C2B4H8.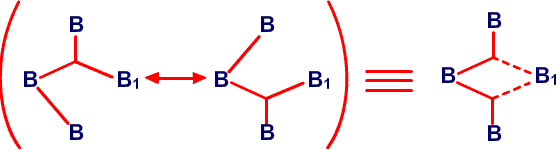
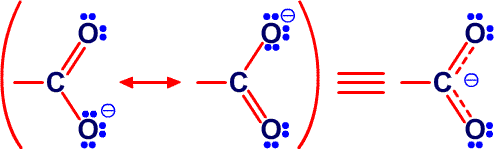
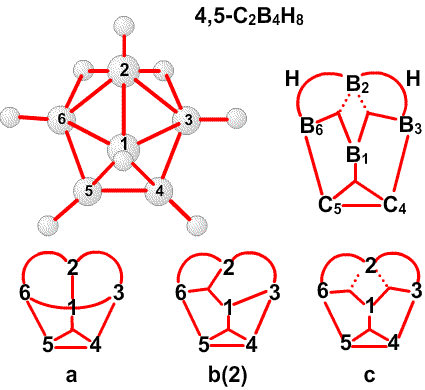
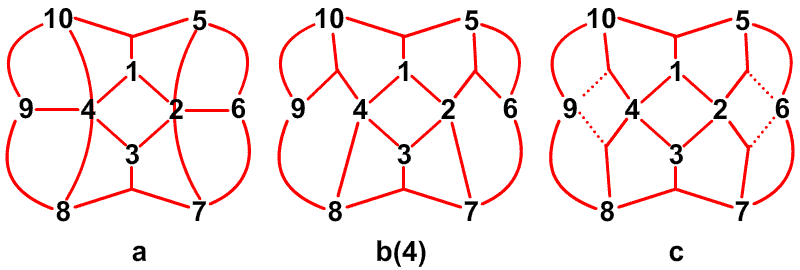
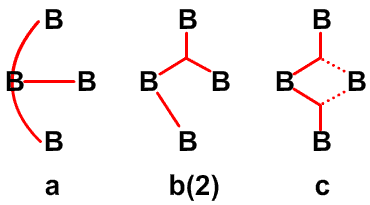
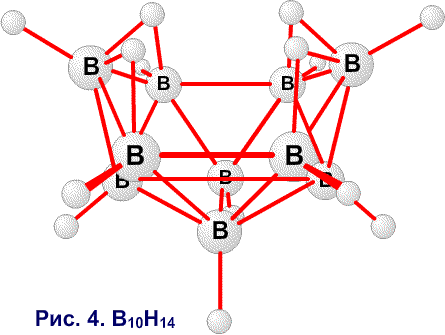
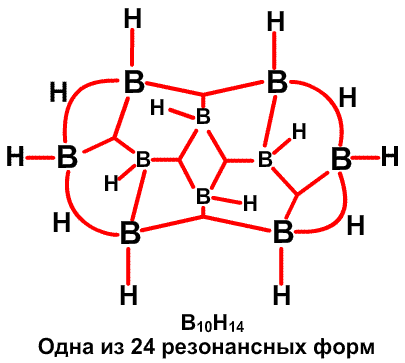
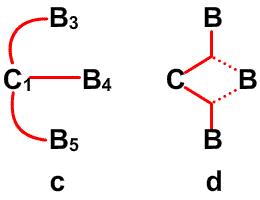
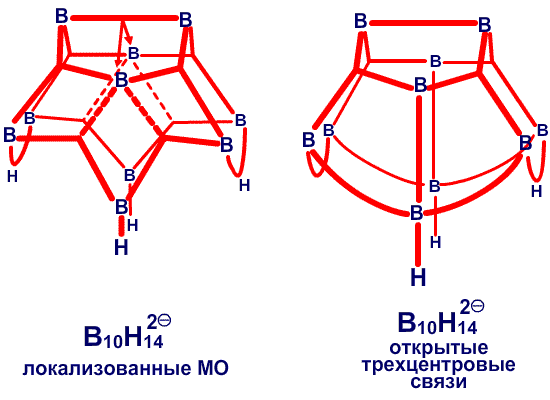
Рис. 30. Наличие фрагментов частичных связей, показанных пунктиром в сторону В6 и В9 в В10Н14, можно ожидать при условии резонанса того рода, что показан на центральном рисунке, или как показано на рисунке слева, если кто-то склонен рисовать открытые трехцентровые связи ВВВ. Предпочтительным является описание с помощью частичных связей.
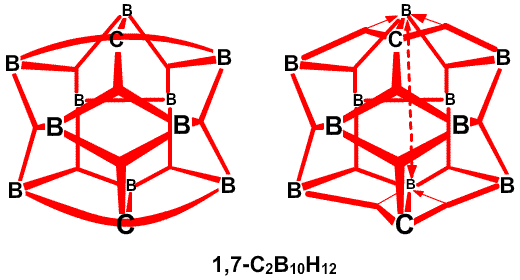
Частичные связи дают чрезвычайно простое валентное описание45 связывания в B10H14 (рис. 30), где отдельные валентные структуры (рис. 30c) заменяют резонансный гибрид 24 структур с центральной трехцентровой связью. Сходное упрощение 45 достигается в B10H142 , где две пары частичных связей показаны пунктирными линиями в направлении атомов B2 и B4, а не в направлении B6 и B9. Аналогичные пары частичных связей обнаружены при реализации процедуры локализации по Бойзу в полиэдрических карборанах 1,2-C2B4H6 (рис. 31) и 1,7-C2B10H12 (рис. 32). Возможно, что эта процедура склонна преувеличить разделение центров тяжести заряда связей, если они расположены при или вблизи от отдельного центра. По этой причине, мы склонны отдавать предпочтение42 почти эквивалентным открытым трехцентровым связям, обнаруженным при помощи процедуры Эдмистона-Рюденберга в 1,2-C2B4H6. Если проверка этой альтернативы в 1,7-C2B10H12 была бы экономически реальной, я предполагаю, что в этой молекуле были бы обнаружены локализованные трехцентровые связи, с центральными атомами углерода, подобно тому как в 1,2-C2B4H6.
, где две пары частичных связей показаны пунктирными линиями в направлении атомов B2 и B4, а не в направлении B6 и B9. Аналогичные пары частичных связей обнаружены при реализации процедуры локализации по Бойзу в полиэдрических карборанах 1,2-C2B4H6 (рис. 31) и 1,7-C2B10H12 (рис. 32). Возможно, что эта процедура склонна преувеличить разделение центров тяжести заряда связей, если они расположены при или вблизи от отдельного центра. По этой причине, мы склонны отдавать предпочтение42 почти эквивалентным открытым трехцентровым связям, обнаруженным при помощи процедуры Эдмистона-Рюденберга в 1,2-C2B4H6. Если проверка этой альтернативы в 1,7-C2B10H12 была бы экономически реальной, я предполагаю, что в этой молекуле были бы обнаружены локализованные трехцентровые связи, с центральными атомами углерода, подобно тому как в 1,2-C2B4H6.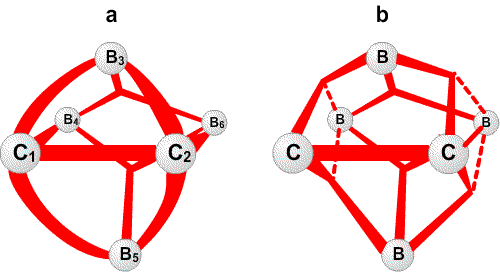
 .
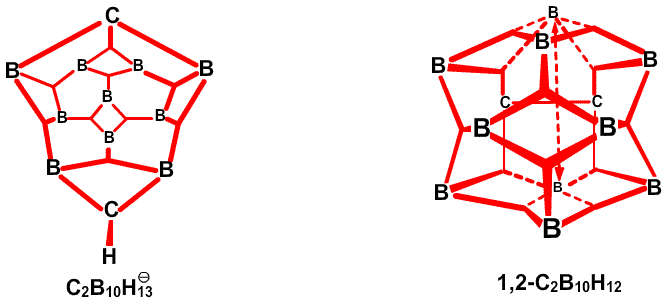
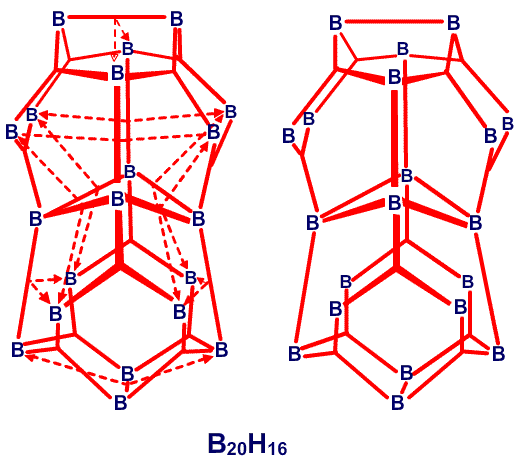
. , который имеет слегка открытое, близкое к икосаэдрическому C2B10, строение, характер связей особенно прост,49 не требуя привлечения резонансных структур или ощутимого участия частичного связывания (рис. 34). В 1,2-C2B10H12, реализуется другая простая идея: характер связей, определенный в результате использования процедуры Бойза, с хорошей степенью приближения является сходной характером связей в 1,7-C2B10H12, несмотря на большую разницу в расположении двух атомов углерода относительно друг друга и соседних атомов бора (рис. 35). Таким образом, здесь присутствует определенная тенденция к инвариантности характера связи в близко родственных геометрических структурах. В изо-B18H22 мы обнаружили50 как донорный эффект одинарной связи, от B4B8 и Bl4H18, так и парциальные связи, к B6 и B16 (рис. 36). В данном случае, донорный эффект одинарной связи больше в направлении к B9, который относительно более электронодефицитен, чем в направлении к B3 и B13. В B20H16 наблюдается заметное проявление донорного эффекта одинарной связи, в особенности в направлении электронодефицитных атомов B9-B16, включительно (рис. 37) и валентные структуры каждой из половинок явным образом схожи с валентными структурами B10H142
, который имеет слегка открытое, близкое к икосаэдрическому C2B10, строение, характер связей особенно прост,49 не требуя привлечения резонансных структур или ощутимого участия частичного связывания (рис. 34). В 1,2-C2B10H12, реализуется другая простая идея: характер связей, определенный в результате использования процедуры Бойза, с хорошей степенью приближения является сходной характером связей в 1,7-C2B10H12, несмотря на большую разницу в расположении двух атомов углерода относительно друг друга и соседних атомов бора (рис. 35). Таким образом, здесь присутствует определенная тенденция к инвариантности характера связи в близко родственных геометрических структурах. В изо-B18H22 мы обнаружили50 как донорный эффект одинарной связи, от B4B8 и Bl4H18, так и парциальные связи, к B6 и B16 (рис. 36). В данном случае, донорный эффект одинарной связи больше в направлении к B9, который относительно более электронодефицитен, чем в направлении к B3 и B13. В B20H16 наблюдается заметное проявление донорного эффекта одинарной связи, в особенности в направлении электронодефицитных атомов B9-B16, включительно (рис. 37) и валентные структуры каждой из половинок явным образом схожи с валентными структурами B10H142 (Рис. 38) в большей степени, чем в B10H14 (Рис. 30).
(Рис. 38) в большей степени, чем в B10H14 (Рис. 30).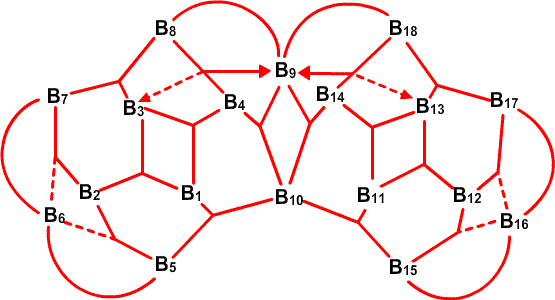
 . Слева показана наиболее устойчивая структура с локализованными орбиталями, тогда как структура с открытыми трехцентровыми связями без донорного эффекта является слишком упрощенной валентной структурой.
. Слева показана наиболее устойчивая структура с локализованными орбиталями, тогда как структура с открытыми трехцентровыми связями без донорного эффекта является слишком упрощенной валентной структурой.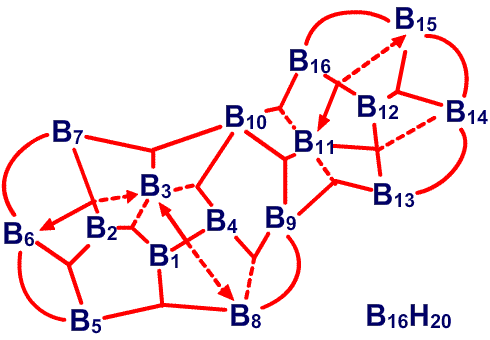
В настоящее время о деталях механизма реакций боранов и родственных им соединений известно значительно меньше в сравнении с органическими реакциями сравнимой сложности. Несомненно, это плодотворная область для дальнейших исследований. На этом я остановлюсь, опуская описание природы связи в больших полиэдрических анионах боранов и других родственных соединениях. Опущены также перегруппировки полиэдров, таутомерия водородного атома, и в частности использование теории химической связи для привнесения до некоторой степени порядка в химические превращения боранов. Основное внимание было сконцентрировано на тех аспектах химической связи, которые были объяснены молекулярными и кристаллическими структурами, изученными нами и другими исследователями за эти многие годы. Моим первоначальным намерением в конце 40х годов было потратить несколько лет на выработку понимания химии боранов, а затем разработать систематическое валентное описание огромного числа «электронодефицитных» интерметаллических соединений. Я мало продвинулся в направлении к этой последней цели. Вместо этого, чрезвычайно разрослась область химии бора, и началось систематическое осмысление некоторых из ее сложностей. Остается только привести список моих научных сотрудников: магистров, студентов, научных сотрудников и других мои коллег, кто был непосредственным соавтором всех этих исследований. За исполнение рисунков к настоящей рукописи и к самой лекции я благодарю Джин Эванс. Я весьма признателен Office of Naval Research, который поддерживал эти исследования в период с 1948 по 1976, необыкновенно долгое время. Отдаю дань почтения большому влиянию Лайнуса Полинга на всю мою научную карьеру. И наконец, настоящая рукопись посвящается памяти моей сестры, Хэлен Портер Липскомб, композитору, учителю и исполнителю.
СПИСОК ЛИТЕРАТУРЫ
1. Stock, A. 1933. Hydrides of Boron and Silicon. The George Fisher Baker Non-Resident Lectureship in Chemistry at Cornell University. Cornell University Press, Ithaca. New York.
2. Sidgwick, N. V. 1950. The Chemical Elements and their Compounds. The Clarendon Press, Oxford, p. 338.
3. Pauling, L. 1940. The Nature of the Chemical Bond. The George Fisher Baker Non-Resident Lectureship in Chemistry at Cornell University. Cornell University Press, Ithaca, New York.
4 . Stitt, F. 1940. “The Gaseous Heat Capacity and Restricted Internal Rotation of Diborane.” J. Chem. Phys. 8, 981-986. Stitt, F. 1941. “Infra-Red and Raman Spectra of Polyatomic Molecules. XV. Diborane.” J. Chem. Phys. 9, 780-785.
5. Longuet-Higgins, H. C. and R. P. Bell. 1943. “The Structure of the Boron Hydrides.” J. Chem. Soc., 250-255.
6. Pitzer, K. S. 1945. “Electron Deficient Molecules. I. The Principles of Hydroboron Structures.” J. Am. Chem. Soc. 67, 1126-l 132.
7. Mulliken, R. S. 1947. “The Structure of Diborane and Related Molecules.” Chem. Rev. 41, 207-217.
8. Longuet-Higgins. 1949. “Substances Hydrogenees avec Defaut d’Electrons.” J. Chim Phys. 46, 268-275.
9. Price, W. C. 1947. “The Structure of Diborane.” J. Chem. Phys. 15, 614. Price, W. 1948. “The Absorption Spectrum of Diborane.” J. Chem. Phys. 16,894-902.
10. Kasper, J. S., C. M. Lucht and D. Harker. 1950. “The Crystal Structure of Decaborane, B10H11.” Acta Cryst. 3, 436-455.
11. Dulmage, W. J. and W. N. Lipscomb. 1951. “The Molecular Structure of Penta-borane.” J. Am. Chem. Soc. 73, 3539. Dulmage, W. ,J. and W. N. Lipscomb. 1952. “The Crystal and Molecular Structure of Pentaborane.” Acta Cryst. 5, 260-264.
12. Hedberg, K., M. E. Jones and V. Schomaker. 1951. “On the Structure of Stable Pentaborane.” J. Am. Chem. Soc. 73, 3538-3539. Hedberg, K., M. E. Jones and V. Schomaker. 1952. “The Structure of Stable Penta-borane.” Proc. Nat. Acad. Sci. 38, G79-686.
13. Nordman, C. E. and W. N. Lipscomb. 1953. “The Molecular Structure of B4H10.” J. Am. Chem. Soc. 75, 4116-4117. Nordman, C. E. and W. N. Lipscomb. 1953. “The Crystal and Molecular Structure of Tetraborane.” J. Chem. Phys. 21, 1856-1864.
14. Jones, M. E., K. Hedberg and V. Schomaker. 1953. “On the Structure of Tetra-borane.” J. Am. Chem. Soc. 75, 4116.
15. Lavine, L. and W. N. Lipscomb. 1954. “The Crystal and Molecular Structure of B5H11 ” J. Chem. Phys. 22, 614-620.
16. Atoji, M. and W. N. Lipscomb. 1953. “The Molecular Structure of B4Cl4.” J. Chem. Phys. 21, 172. Atoji, M. and W. N. Lipscomb. 1953. “The Crystal and Molecular Structure of B4Cl4.” Acta Cryst. 6, 547-550.
17. Eriks, K., W. N. Lipscomb and R. Schaeffer. 1954. “The Boron Arrangement in a B6 Hydride.” J. Chem. Phys. 22, 754-755.
18. Hirshfeld, F. L., K. Eriks, R. E. Dickerson, E. L. Lippert, Jr. and W. N. Lipscomb. 1958. “Molecular and Crystal Structure of B6H10.” ,J. Chem. Phys. 28, 56-61.
19. Abrahams, S. C., R. L. Collin, W. N. Lipscomb and T. B. Reed. 1950. “Further Techniques in Single-Crystal X-ray Diffraction Studies at Low Temperatures.” Rev. Sci. Instr. 21, 396-397.
20. Kaufman, H. S. and I. Fankuchen. 1949. “A Low Temperature Single Crystal X-ray Diffraction Technique.” Rev. Sci. Instr. 20, 733-734.
21. Dickerson, R. E., P. J. Wheatley, P. A. Howell and W. N. Lipscomb. 1957. “Crystal and Molecular Structure of B9H15.” J. Chem. Phys. 27, 200-209.
22. Eberhardt, W. H., B. Crawford, Jr. and W. N. Lipscomb. 1954. “The Valence Structure of the Boron Hydrides.” J. Chem. Phys. 22, 989.
23. Longuet-Higgins, H. C. and M. de V. Roberts. 1954. “The Electronic Structure of the Borides MB,.” Proc. Roy. Soc. (London) A224, 336-347. Longuet-Higgins, H. C. and M. de V. Roberts. 1955. “The Electronic Structure of an Icosahedron of Boron Atoms.” Proc. Roy. Soc. (London) A230, 110-l 19.
24. Lipscomb, W. N., Boron Hydrides. (W. A. Benjamin, Inc. 1963).
25. Dickerson, R. E. and W. N. Lipscomb. 1957. “Semitopological Approach to Boron-Hydride Structures.” J. Chem. Phys. 27, 212-217.
26. Lipscomb, W. N. 1964. “Geometrical Theory of Boron Hydrides.” Inorg. Chem. 3, 1683-1685.
27. Epstein, I. R. and W. N. Lipscomb. 1971. “Boron Hydride Valence Structures: A Topological Approach.” Inorg. Chem. 10, 1921-1928.
28. Moore, E. B., Jr., L. L. Lohr, Jr. and W. N. Lipscomb. 1961. “Molecular Orbitals in Some Boron Compounds.” J. Chem. Phys. 35, 1329-I 334.
29. Hawthorne, M. F. 1968. “The Chemistry of the Polyhedral Species Derived from Transition Metals and Carboranes.” Accounts of Chem. Res. 1, 281-288.
30. Hoffmann, R. and W. N. Lipscomb. 1962. “Boron Hydrides: LCAO-MO and Resonance Studies.” J. Chem. Phys. 37, 2872-2883.
Hoffmann, R, and W. N. Lipscomb. 1962. “Theory of Polyhedral Molecules. I. Physical Factorizations of the Secular Equation.” J. Chem. Phys. 36, 2179-2189.
Hoffmann, R. and W. N. Lipscomb. 1962. “Theory of Polyhedral Molecules. III. Population Analyses and Reactivities for the Carboranes.” J. Chem. Phys. 36, 3489- 3493.
31. Woodward, R. B. and R. Hoffmann. 1970. The Conservation of Orbital Symmetry. Verlag Chemie GmbH, Academic Press.
32. Eaton, G. R. and W. N. Lipscomb. 1969. NMR Studies of Boron Hydrides and Related Compounds. W. A. Benjamin, Inc.
33. Stevens, R. M., R. M. Pitzer and W. N. Lipscomb. 1963. “Perturbed Hartree-Fock Calculations. I. Magnetic Susceptibility and Shielding in the LiH Molecule.” J. Chem. Phys. 38, 550-560.
34. Lipscomb, W. N. 1972. “Molecular Properties.” MTP International Review of Science, Theoretical Chemistry. Physical Chemistry Series One. Volume 1. Editors: A. D. Buckingham and W. Byers Brown. Butterworths, London, England. pp. 167-196.
35. Hegstrom, R. A. and W. N. Lipscomb. 1968. “Paramagnetism in Closed-Shell Molecules.” Rev. Mod. Phys. 40, 354-358.
36. Pitzer, R. M. and W. N. Lipscomb. 1963. “Calculation of the Barrier to Internal Rotation in Ethane.” J. Chem. Phys. 39, 1995-2004.
37. Newton, M. D., F. P. Boer and W. N. Lipscomb. 1966. “Molecular Orbital Theory for Large Molecules. Approximation of the SCF LCAO Hamiltonian Matrix.” J. Am. Chem. Soc. 88. 2353-2360. 38.
Boer, F. P.. M. D. Newton and W. N. Lipscomb. 1966. “Molecular Orbitals for Boron Hydrides Parameterized from SCF Model Calculations.” J. Am. Chem. Soc. 88, 2361-2366.
39. Halgren, T. A. and W. N. Lipscomb. 1972. “Approximations to Self-Consistent Field Molecular Wavefunctions.” Proc. Nat. Acad. Sci. USA 6.9, 652-656.
Halgren, T. A. and W. N. Lipscomb. 1973. “Self-Consistent Field Wavefunctions for Complex Molecules. The Approximations of Partial Retention of Diatomic Differential Overlap. J. Chem. Phys. 58, 1569-1591.
40. Edmiston, C. and K. Ruedenberg. 1963. “Localized Atomic and Molecular Orbitals.” Rev. Mod. Phys. 35, 457-465.
41. Boys, S. F. 1966. Quantum Theory of Atoms, Molecules and the Solid State. (P. O. Lowdin, Ed.). Academic Press, New York. pp. 253-262.
42. Kleier, D. A., T. A. Halgren, J. H. Hall, Jr. and W. N. Lipscomb. 1974. “Localized Molecular Orbitals for Polyatomic Molecules. I. A Comparison of the Edmiston-Ruedenberg and Boys Localization Methods.” J. Chem. Phys. 61, 3905-3919.
43. Switkes, E., W. N. Lipscomb and M. D. Newton. 1970. “Localized Bonds in Self-Consistent-Field Wave Functions for Polyatomic Molecules. II. Boron Hydrides.” J. Am. Chem. Soc. 92, 3847-3853.
44. Epstein, I. R., D. S. Marynick and W. N. Lipscomb. 1973. “Localized Orbitals for 1,2- and 1,6-Dicarbahexaborane(6). The Open Three-Center Bond, and Implications for Carborane Topology.” J. Am. Chem. Soc. 95, 1760-1766.
45. Hall, J. H., .Jr., D. A. Dixon, D. A. Kleier, T. A. Halgren, L. D. Brown and W. N. Lipscomb. 1975. “Localized Molecular Orbitals for Polyatomic Molecules. II. Structural Relationships and Charge Distributions for Open Boron Hydrides and Ions.” J. Am. Chem. Soc. 97. 4202-4212.
46. Marynick, D. S. and W. N. Lipscomb. 1972. “Self-Consistent Field Wave Function and Localized Orbitals for 2,4-Dicarbaheptaborane(7). The Fractional Three-Center Bond.” J. Am. Chem. Soc. 94, 8692-8699.
47. Dixon, D. A. and W. N. Lipscomb. 1976. “Electronic Structure and Bonding of the Amino Acids Containing First Row Atoms.” J. Biol. Chem. 251, 5992-6000.
48. Marynick, D. S. and W. N. Lipscomb. 1972. “A Self-Consistent Field and Localized Orbital Study of 4,5-Dicarbahexaborane(8).” J. Am. Chem. Soc. 94, 8699-8706.
49. Tolpin, E. I. and W. N. Lipscomb. 1973. “Crystal and Molecular Structure of Tetra-methylammonium C,C’-Diphenylundecahydrodicarbanido-dodecaborate . J. Inog. Chem. 12, 2257-2262.
. J. Inog. Chem. 12, 2257-2262.
50. Dixon, D. A., D. A. Kleier, T. A. Halgren and W. N. Lipscomb. 1976. “Localized Molecular Orbitals for Polyatomic Molecules. IV. Large Boron Hydrides.” J. Am. Chem. Soc. 98, 2086-2096.
51. Kreevoy, M. M. and J. E. C. Hutchins. 1972. “H2BH3 as an Intermediate in Tetra-hydridoborate Hydrolysis.” .J. Am. Chem. Soc. 94, 6371-6376.
52. Pepperberg, I. M., T. A. Halgren and W. N. Lipscomb. 1976. “A Molecular Orbital Study of the Role of BH5 in the Hydrolysis of BH4”. J. Am. Chem. Soc. 98, 3442--3451.
53. Hoheisel, C. and W. Kutzelnigg. 1975. “Ab Initio Calculation Including Electron Correlation of the Structure and Binding Energy of BH5 and B2H7 .” J. Am. Chem. Soc. 97, 6970-6975.
54. Collins, J. B., P. v. R. Schleyer, J. S. Binkley,.J. A. Pople and L. Radom. 1976. J. Am. Chem. Soc., 98, 3436-3441 (1976).
55. Hariharan, P. C., W. A. Latham and J. A. Pople. 1972. “Molecular Orbital Theory of Simple Carbonium Ions.” Chem. Phys. Lett. 14, 385-388.
56. Dixon, D. A., I. M. Pepperberg and W. N. Lipscomb. 1974. “Localized Molecular Orbitals and Chemical Reactions. II. A Study of Three-Center Bond Formation in the Borane-Diborane Reaction.” J. Am. Chem. Soc. 96, 1325-1333.
57. Dupont, J. A. and R. Schaeffer. 1960. “Interconversion of Boranes. I. A. Kinetic Study of the Conversion of Tetraborane-10 to Pentaborane-11. “J. Inorg. Nucl. Chem. 15, 310 -315.