Атом и молекула
|
Джильберт Н. Льюис
Journal of the American Chemical Society
Volume 38, 1916, pages 762-786
Получено - январь 26, 1916 |
В статье, озаглавленной "Валентность и таутомерия"1 я имел возможность указать на большую важность замены общепринятой классификации химических веществ, неорганических и органических, более общей классификацией, проводящей различие между полярными и неполярными веществами. Эти две классификации в общих чертах совпадают, поскольку многие неорганические вещества сильно полярны, тогда как большинство органических веществ принадлежат к классу неполярных веществ; так например, хлорид калия является представителем сильно полярного типа, а метан - неполярного. Тем не менее, имеется много неорганических веществ, которые в обычных условиях преимущественно неполярны, и некоторые органические вещества, которые, по меньшей мере, в определенной части молекулы, являются сильно полярными. |
| 1 настоящий журнал, 35, 1448 (1913); см. также важную статью Брэя и Бранча, Ibid, 35, 1440 (1913) |
Эта статья была очевидно неизвестна Сэру Д.Д. Томсону1, когда он писал, в 1914, чрезвычайно интересную статью о "Силах между атомами и химическом сродстве", в которой он пришел к выводам, поразительно совпадающим с моими, и детально обсудил теории строения атомов и молекул, которые привели его к этим выводам.
Чтобы оценить важность и полезность отличий между полярным и неполярным типами химических молекул не нужны какие либо гипотезы, однако, для более детального изучения природы таких отличий абсолютно необходима какая-либо теория строения атома. Такую теорию я применял в течение нескольких лет для объяснения химических явлений, однако она до настоящего времени не была опубликована. В настоящей статье я намерен представить подробное изложение такой теории, поскольку она обладает большим сходством с некоторыми современными теориями строения атома, и то же время показывает некоторые принципиальные моменты отличий от них. В качестве введения полезно дать общую характеристику полярных и неполярных соединений. |
Полярные и неполярные типы |
| Наиболее примечательные различия в свойствах соединений кране полярного и крайне неполярного типов собраны в приведенной ниже таблице, цитируемой по моим предыдущим статьям: |
Полярные |
Неполярные |
| Подвижные |
Неподвижные |
| Реакционноспособны2 |
Инертны |
| Конденсированная структура |
Каркасная структура |
| Таутомерия |
Изомерия |
| Электрофильны |
Неэлектрофильны |
| Ионизированы |
Неионизированы |
| Ионизирующие растворители |
Неионизирующие растворители |
| Высокая диэлектрическая константа |
Низкая диэлектрическая константа |
| Молекулярные комплексы |
Немолекулярные комплексы |
| Ассоциация |
Нет ассоциации |
| Аномальные жидкости |
Нормальные жидкости |
|
1 Phil. Mag., 27, 757 (1914).
2 В моей предыдущей статье слова "инертны" и "реакционноспособны" по ошибке были переставлены местами и оказались не в тех столбцах этой таблицы. |
| Все эти свойства, с учетом которых были сделаны фундаментальные разграничения между этими двумя типами, и которые не первый взгляд кажутся не связанными друг с другом, на самом деле тесно взаимосвязаны, и все эти различия обусловлены единственной причиной. Даже не выдвигая каких либо специальных гипотез, с высокой степенью надежности можно принять, что существенная разница между полярной и неполярной молекулой заключается в том, что, в первой, один или большее число электронов удерживаются относительно слабыми силами и поэтому они способны освободиться из своего прежнего положения в атоме и в предельном случае перейти к другому атому, превращая тем самым молекулу в диполь или мультиполь с высоким электрическим моментом. Так, например, в сильнополярной молекуле, такой как хлорид натрия, весьма вероятно, что, по меньшей мере, в большинстве молекул атом хлора приобрел единичный отрицательный заряд, а атом натрия, соответственно, единичный положительный заряд, и что процесс ионизации состоит только в дальнейшем разделении этих заряженных частиц. |
| Если же теперь мы рассмотрим неполярную молекулу, т.е. молекулу, в которой электроны, принадлежащие отдельным атомам, удерживаются настолько сильно, что они не перемещаются далеко от их нормального положения, тогда как в полярных молекулах электроны, будучи более подвижными, перемещаются и разделяют, таким образом, молекулу на положительную и отрицательную части, тогда все отличительные свойства двух типов соединений становятся неизбежным следствием такого предположения, как это будет показано ниже. |
| Так, полярные соединения с их подвижными электронами охотно вступают в такие взаимодействия, которые представляют собой очень небольшое число стабильных состояний, тогда как неполярные молекулы, отдельные части которых прочно удерживаются друг с другом, являются инертными и нереакционноспособными, и поэтому могут группироваться в многочисленные сложные структуры органической химии. Большинство органических соединений, в особенности те из них, которые содержат такие элементы, как кислород и азот, и те, которые называют ненасыщенными, демонстрируют, по меньшей мере, в некоторых частях молекулы, отчетливо выраженный полярный характер. В таких случаях мы имеем дело с явлением таутомерии, когда две или большее число форм молекулы быстро превращаются одна в другую и сосуществуют в условиях подвижного равновесия. Таутомерия не является типичной особенностью органических веществ, однако является, с другой стороны, преобладающей характерной чертой многих неорганических веществ, которые ведут себя так, как если бы их разнообразные формы находились в крайне подвижном равновесии. |
| Когда молекула в результате перемещения электрона или электронов, превращается в диполь (или мультиполь) с высоким электрическим моментом, что происходит когда ее заряженные фрагменты разделяются на значительное расстояние, силы притяжения ее к другому молекулярному диполю будут ощущаться на значительном среднем расстоянии, и два или большее число таких диполей часто объединяются в единый агрегат, в котором положительная часть одной молекулы находится на близком расстоянии от отрицательной части другой. Молекулы полярных веществ поэтому демонстрируют не только необычно высокое межмолекулярное притяжение на расстоянии, но часто соединяются друг с другом, демонстрируя тем самым явление, известное как ассоциация. Фактически это вещества, которые являются отчетливо полярными, вроде аммиака, воды, кислот и спиртов, которые составляют, за счет ассоциации, а также высокого межмолекулярного притяжения, класс жидкостей, которые называются аномальными в отношении многочисленных свойств, таких как критическая точка, давление паров, теплота испарения, вязкость и поверхностное натяжение. |
| Кроме того, полярное вещество может соединяться с другими веществами с образованием таких агрегатов, которые известны как молекулярные соединения или комплексы, и они могут также соединяться с веществами, которые сами по себе не являются заметно полярными, т.е. в присутствии полярного вещества все другие вещества становятся более полярными. |
| Это важное влияние полярных молекул, заключающееся в увеличении полярности других молекул, которому я уделил внимание в моей предыдущей статье, довольно подробно обсуждается Томсоном. Молекулярный диполь с небольшим молекулярным моментом, который лишь в незначительной степени притягивается аналогичной молекулой, в ощутимой степени притягивается полярной молекулой или диполем с большим моментом, и может образовать с ней двойную молекулу. В этом процессе более слабый диполь вытягивается, и его момент возрастает. В общем, если две молекулы объединяются между собой, или просто сближаются друг с другом, каждая из них ослабляет силы, которые связывают между собой заряды другой молекулы, и электрический момент каждой из молекул увеличивается. |
| Этот эффект увеличения полярного характера молекулы при соединении или в непосредственной близости с другими полярными молекулами является в заметной степени кумулятивным, вследствие чего две молекулы при их сближении или связывании друг с другом становятся более полярными, они более сильно притягивают к себе другие молекулы, однако это в еще большей степени увеличивает их полярный характер. Это наглядно иллюстрируется многочисленными явлениями. Так, например, два вещества в газообразном состоянии могут лишь незначительно отличаться по своей полярности, однако когда они становятся конденсированными жидкостями, разница зачастую становится весьма значительной. Полярный характер вещества зависит, поэтому, не только от специфических свойств индивидуальных молекул, но также от того, что можно назвать силой полярного окружения. Не пытаясь дать каких либо количественных определений этим понятиям, можно построить график зависимости, рис. I, степени полярности вещества по оси ординат, от силы полярного окружения по оси абсцисс. В таком случае мы получаем для всех веществ кривую такого типа, показанную на рисунке, где пунктирная линия представляет собой наивысшую степень полярности, т.е. полную ионизацию. Различные чистые вещества в жидкое состояние переходят в различных точках, грубо говоря, гексан в A; бензол в B; эфир в C; эфиры в D; вода, аммиак, спирты, амины, кислоты между D и F; а расплавленные соли в G. В последнем случае, поскольку вещество практически достигло своей наивысшей возможной полярности, оно не будет испытывать сильного влияния увеличения силы полярного окружения. На другом конце кривой вещество в точке A в сильно полярном окружении может перемещаться в точку B, а вещество в точке B может перемещаться к точке C, однако они не становятся в заметной степени полярными. Это имеет место в промежуточной области, где вещества испытывают влияния в большей степени небольших изменений в характере окружения. Так, например, соляная кислота, которая в чистом состоянии не является сильно полярной, достигает наивысшего возможного состояния полярности при растворении в воде. Такие изменения, происходящие в данной области, часто в значительной степени усиливаются при образовании комплексов, и в этом случае мы получаем правило Абега и Бодлендера, согласно которому слабый электролит становится обычно сильным электролитом если его слабый ион превращается в комплексный ион. |
| Таким образом, мы переходим к рассмотрению электрических свойств, которые отличают полярные вещества от неполярных, или, в соответствии с терминологией, использованной мною ранее,1 которые проводят различие между сильными электрофилами и слабыми электрофилами. |
| Первое отличие заключается в диэлектрической константе. Разница в диэлектрических константах вещества и диэлектрической константы вакуума является мерой числа свободных зарядов в веществе, умноженного на среднее расстояние, в пределах которого эти заряды перемещаются под влиянием определенного электрического поля. В полярной молекуле силы, противодействующие разделению зарядов, будучи уже ослабленными, могут быть разделены на еще большие расстояния в электрическом поле, и что более важно, диполи (или мультиполи), которые уже существуют в полярном веществе, могут, в результате вращения, ориентироваться в электрическом поле, давая тем самым большие токи смещения и тем самым высокие диэлектрические постоянные. В связи с этим Томсон обратил внимание на работу Бэдекера2, который показал, что даже в газообразном состоянии такие вещества как аммиак, вода и соляная кислота обладают аномально высокой диэлектрической постоянной. |
| И наконец, полярное вещество, в чистом состоянии или будучи растворенным в другом растворителе, явно будут теми веществами, которые легко ионизируются. Кроме того, полярные вещества являются сильно ионизирующими растворителями, тогда как другое вещество соединяется с высоко полярным веществом, или даже просто растворяется в таком растворителе без фактического соединения молекул, степень его собственной полярности значительно возрастает. |
| Столь различными полярные и неполярные типы являются лишь в предельном случае, тем не менее, необходимо исследовать, является ли это различие разницей в типе или только в степени. |
1 Льюис и Вилер, Z. physik. Chem., 56, 189 (1906).
2 Z. physik. Chem., 36, 305 (1901). |
| Если бы существовало резкое и всегда легко узнаваемое различие между полярной и неполярной молекулой, тогда вещество было бы более полярным или менее полярным в соответствии с тем, обладает ли оно большей или меньшей долей молекул первого типа. Это было бы простым и во многих случаях удовлетворительным объяснением различий в поведении различных веществ, однако при исследовании всей области химических явлений мы, я уверен, будем вынуждены прийти к выводу, что различие между наиболее полярными и неполярными типами сводится только к различию в степени полярности, и что единичная молекула, или даже часть молекулы, может переходить от одного крайнего типа к другому не в результате внезапного дискретного изменения, а в результате незаметного плавного перехода. Природа такого перехода будет обсуждаться в следующих разделах: |
Кубический атом. |
| Несколько лет назад, для объяснения удивительного факта, ставшего известным как закон Абега о валентности и противовалентности, в соответствии с которым разность между максимальной отрицательной и положительной валентностью или степенями окисления элемента часто равна восьми и никогда не превышает восьми, я разработал нечто, что может быть названо теорией кубического атома. Эта теория, хотя она стала известной определенному числу моих коллег, никогда не публиковалась, отчасти потому, что она во многих аспектах не доработана. Хотя многие из элементов несовершенства остались, и хотя эта теория утратила сегодня большую часть своей новизны, которой она первоначально обладала, она представляется мне, по сути, более правдоподобной, чем некоторые другие теории строения атома, которые были предложены, и я не могу дать более полного обсуждения природы отличий между полярными и неполярными соединениями без подробного рассмотрения этой теории. |
|
| 1Эти рисунки взяты из памятной записки, датированной 28 марта 1902, вместе с моделями я привожу замечания, касающиеся различных типов химических соединений; различные возможные методы расположения электронов на внешней оболочке атома и возможность существования внутриатомной изомерии; взаимосвязь между симметричным строением и объемом атома, и некоторые рассуждения относительно строения атома гелия, которые, как мы увидим, были, вероятно, отчасти неверными. |
| Дата появления данной теории упомянута не с целью заявления какого либо приоритета в отношении тех частей, которые перекрываются с существующими теориями, но в связи с тем фактом, что сходство независимо разработанных теорий увеличивают вероятность того, что все они отражают некоторые характеристики фундаментальной реальности. |
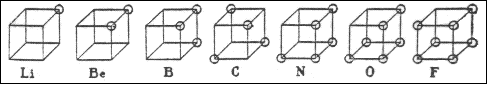
| Изображения строения атома, представленные на рис. 2,1 в которых кружки представляют электроны внешней оболочки нейтрального атома, были разработаны для объяснения некоторых важных законов химического поведения с помощью следующих постулатов: |
| 1. Неотъемлемой частью каждого атома является центральная часть, или ядро, которая остается неизменной в обычных химических превращениях и которая обладает избытком положительного заряда, численно соответствующим порядковому номеру группы в периодической таблицы, в которой элемент находится. |
| 2. Атом состоит из центральной части (ядра) и его внешнего окружения, или, оболочки, которая в случае нейтрального атома содержит отрицательно заряженные электроны, число которых равно избытку положительных зарядов центральной части, однако число электронов оболочки может изменяться в ходе химических превращений между 0 и 8. |
| 3. Атом стремится удержать четное число электронов в оболочке, в особенности, восемь электронов, которые обычно расположены симметрично на восьми вершинах куба.1 |
| 4. Две атомные оболочки взаимно непроницаемы. |
| 5. Электроны обычно могут легко переходить из одного положения во внешней оболочки в другое. Тем не менее, они удерживаются в своих положениях более или менее прочными силами, и эти положения, а также величина сил определяются природой атома и других атомов, с ним связанных. |
| 6. Электрические силы между частицами, располагающимися очень близко друг к другу, не описываются простым законом обратных квадратов, который действует на больших расстояниях. |
| Необходимо подробнее обсудить эти постулаты, чтобы прояснить их смысл. Первый постулат касается двух частей атома, которые соответствуют, в первом приближении, внутреннему и внешнему кольцу в модели атома Томсона. Ядро является той частью атома, которая остается неизменной в ходе обычного химического превращения, является достаточно важным и заслуживает отдельного символа. Для обозначения ядер я предлагаю обычный символ элемента, напечатанных другим способом. Так, например, Li обозначает внутреннюю часть атома лития. Она имеет положительный заряд и эквивалентна иону лития Li+. Be имеет два положительных заряда, B три, C четыре, N пять, O шесть и F семь. |
| Можно ожидать, что следующий элемент в этом ряду, неон, будет иметь внутреннюю часть с восемью положительными зарядами и внешнюю оболочку, содержащую восемь электронов. В определенном смысле это несомненно так. Однако как утверждается в Постулате 3, группа из восьми электронов в оболочке является чрезвычайно стабильной, и эта стабильность тем больше, чем меньше разница в зарядах между ядром и этой группой из восьми электронов. Так, например, во фторид-анионе ядро имеет заряд +7, и отрицательный заряд группы из восьми электронов превышает его всего на единицу. Действительно, в соединениях фтора со всеми другими элементами, фтору приписывается степень окисления -1. В случае кислорода, где группа из восьми электронов имеет заряд, превышающий заряд ядра на две единицы, степень окисления считается равной -2 почти в каждом соединении. Считается, что азот обычно имеет степень окисления -3 в таких соединениях как аммиак и нитриды. Может оказаться удобным приписать иногда углероду степень окисления -4, однако никогда не считалось необходимым приписывать бору степень окисления -5, или бериллию -6, или литию -7. Поэтому неон, с внутренним положительным зарядом равным 8 и внешней группой из восьми электронов, является настолько стабильным, что он, целиком, может рассматриваться как внутренняя часть неона и можно написать Ne = Ne1. |
| 1 Позже мы увидим целесообразность модификации этого утверждения о кубическом расположении основной группы из восьми электронов. |
| Следующий элемент, натрий, начинает застройку новой внешней оболочки2 и Na = Na+, Mg = Mg++, и так далее. В моей первоначальной теории я предполагал, что элементы периодической таблиц устроены как бы поблочно, образуя концентрические кубы. Так, калий должен быть похож на натрий, за исключением того, что он будет иметь во внутренней части атома один дополнительный куб. Эта идея, как будет видно позже, нуждается в модификации, однако тем не менее она дает конкретную картину, являющуюся иллюстрацией теории. |
| Таким образом, имеются внутренние части атомов3 с единичным положительным зарядом H, Li, Na, K, Rb, Cs; с двумя положительными зарядами Be, Mg, Ca, Sr, Ba; с тремя зарядами B, Al, Sc; с четырьмя зарядами C, Si; с пятью зарядами N, P, As, Sb, Bi; с шестью зарядами O, S, Se, Te и группа радиоактивных изотопов; с семью зарядами F, Cl, Br, I; и с нулевым зарядом He, Ne, Ar, Kr, Xe и Nt. Только эти элементы будут рассмотрены в настоящей статье. Остальные элементы образуют класс, в котором внутренние части атомов не являются однозначно определяемыми и неизменными в ходе химических превращений. Это – один из элементов незавершенности теории. Тем не менее, эта классификация не является произвольной, но вынужденной для нас, и элементы, которые в нее включены, составляют столь большую часть материала, на которой базируется наука химия, что изучение их соединений представляет собой проблему большого значения. |
| Постулат 2 невозможно рассмотреть в полной мере, кроме как в связи с четвертым постулатом, однако в предположении, что мы понимаем значение восстановления или окисления элемента (по меньшей мере, в случае сильно полярных соединений), восстановление означает увеличение, а окисление - уменьшение числа электронов во внешней оболочке элемента. Так, для иллюстрации, и с такими оговорками, которые сейчас будут показаны как необходимые, можно утверждать, что хлор имеет восемь электронов на внешней оболочке в хлоридах, шесть в гипохлоритах, четыре в хлоритах, два в хлоратах и ни одного в перхлоратах. |
| 1 Нельзя принять, даже в случае элементов, выбранных для обсуждения, что различие между внутренней частью атома и оболочкой является строго определенным. Так, при ионизации неона электронами электрического разряда, электроны должны быть выбиты из группы, которую мы рассматриваем как принадлежащую самой внутренней части атома. |
| 2 Периодичность в таблице элементов, обусловленная последовательным добавлением группы из восьми электронов к внутренней части атомов, имеет близкую аналогию в соединениях. Так, ион аммония имеет девять положительных зарядов во внутренней части и восемь электронов в оболочке, однако эти восемь электронов, образуя стабильную группу, делают ион аммония полностью аналогичным внутренней части атомов щелочных металлов. |
| 3 Я полагаю, довольно просто запомнить, что внутренняя часть натрия имеет один положительный заряд, а внутренняя часть хлора – семь положительных зарядов, и т. д., однако, может оказаться полезным, в педагогических целях, прикрепить к символу внутренней части атома цифровой индекс, показывающий число зарядов. |
| Постулат 3 лучше всего можно проиллюстрировать с помощью формулы, в которой электроны атомных оболочек рассматриваются как атомы элемента электричества1 с символом E. Также как в случае обычных символов мы используем два типа формул, одной из которых является брутто-формула, представляющая ничего иного кроме как химический состав вещества, и другая – структурная формула, в которой делается попытка представить относительное расположение атомов, точно так же мы можем, с помощью новых символов, использовать два типа формул. Позже мы обсудим структурные формулы, однако на данный момент мы можем рассматривать брутто-формулы как состоящие из ядер атомов и электронов оболочек. Внутренняя часть атома лития имеет один положительный заряд, фтор имеет семь таких зарядов, так что нейтральная молекула фторида лития может быть представлена как LiFE8. В сульфате лития S и O имеют по шесть положительных зарядов, и Li2SO4 = Li2SO4E32; SO4-- = SO4E32. В каждом веществе, в котором каждый элемент имеет либо свою высшую, либо свою низшую степень окисления, E будет кратным 8. Так, например NH3 = NH3E8, H2O = H2OE8, KOH = KOHE8, NaNO3 = NaNO3E24, AlO3H3 = AlO3H3E24, MgCl2 = MgCl2E16, K2CO3 = K2CO3E24. В соединениях, в которых элементы имеют степени окисления промежуточные между высшими и низшими значениями, числа электронов, как правило, не кратны 8, однако почти во всех случаях являются четным числом. Так, например SO2 = SO2E18, NaClO = NaClOE14, C2H2 = C2H2E10, C6H6O = C6H6OE36. |
| Исключительная общность этого правила демонстрируется тем фактом, что среди десятков тысяч известных соединений элементов, рассмотренных с этой точки зрения, известны лишь несколько исключений. Я могу утверждать, что все соединения такого рода, которые мне известны, образуют очень интересный класс соединений. Все они обладают высокой реакционной способностью и стремятся к превращению в вещества с четным числом электронов. В первую очередь следует упомянуть некоторые из элементов, которые сами по себе находятся в моноатомном состоянии, и в качестве типичного примера можно привести Na = NaE и I = IE7. Кроме них,2 мы имеем NO = NOE11, NO2 = NO2E17, ClO2 = ClO2E19, (C6H5)3C = (C6H5)3CE91, а также другие триарилметилы3, а также, вероятно, интенсивно окрашенные соединения щелочных металлов и диарилкетонов,1 а также окрашенные вещества, которые, по мнению Виланда, содержат двухвалентный и четырехвалентный азот.2 |
| 1 Д-р Бранч любезно указал мне на небольшую книгу Сэра Вильяма Рамсея ("The Temple Primers; Современная химия"), в которой он использует очень похожие формулы, также содержащие E. |
| 2 Возможно гипофосфористая кислота также должна быть включена в этот список, однако доказательства касательно ее молекулярного веса не кажутся убедительными. |
| 3 См. Обзор Гомберга, настоящий журнал, 36, 1144 (1914). |
| В особенности следует отметить то, что такие вещества при помещении в полярное окружение почти всегда превращаются в соединения с четным числом электронов во внешней оболочке атома. Так при растворении в воде NO2 превращается в азотистую и азотную кислоты, и даже в чистом жидком тетраоксиде азота мы имеем все основания предполагать, вследствие наличия электропроводности, что в нем присутствуют такие ионы как NO2+ = NO2E16 и NO2¯ = NO2E13 [sic, вместо 13 должно быть 18]. Аналогично, ClO2 растворяется с образованием в определенной степени хлорноватой и хлористой кислот, трифенилметил растворяется в жидкой двуокиси серы с образованием проводящего раствора, содержащего, предположительно, ионы типа (C6H5)3C+ и (C6H5)3C¯. Натрий в металлическом состоянии или при растворении в таком растворителе как жидкий аммиак, диссоциирует в соответствии с уравнением NaE = Na+ + E. Поэтому в общем можно утверждать, что вещество, в брутто-формуле которого присутствует нечетное число электронов, слабо удерживает один электрон, и в среде, которая ослабляет все электрические взаимодействия, т.е. в полярной среде, нечетный электрон может быть полностью утерян. В отличие от упомянутых случаев, неспаренный электрон достаточно прочно связан в молекуле NO, и даже в полярном окружении силы, удерживающие этот электрон, оказываются достаточно мощными. Тем не менее, в присутствии любого окислительного агента, такого как кислород, т.е. в присутствии вещества, обладающего сильным стремлением к принятию электрона, сразу же происходит обмен. |
| Молекулы такого класса, которые содержат нечетный, или неспаренный электрон, в целях краткости будут называться нечетными молекулами. Нечетная молекула содержит как минимум один атом с нечетным числом электронов в оболочке. Такой атом называется нечетным атомом. |
Постулат 4 ставит вопрос очень большой важности. Начиная с первого предположения Гельмгольца, было предпринято множество попыток объяснить химическую связь предположением, что при образовании соединения некоторые из электронов одного атома полностью переходят в другой атом, и что образующиеся при этом различным образом заряженные части молекулы удерживаются вместе силами электрического притяжения. Такие теории, на мой взгляд, совершенно не соответствуют действительности, за исключением случая веществ сильно полярного типа. Этот факт был признан Томсоном в его последней статье, в которой он вводит совершенно другой тип химической связи в случае соединений, которые мы называем неполярными. Однако, в соответствии с теорией, которую я сейчас излагаю, нет необходимости рассматривать два предельных типа химической связи, соответствующих сильно полярным и сильно неполярным соединениям, как различные по природе, но только как различные в степени. |
| 1 Шленк и Вайкель, Ber., 44, 1182 (1911). |
| 2 Виланд, Ann., 381, 200 (1913); Ber., 47, 2111 (1914). |
| Это связано с предположением о непроницаемости атомных оболочек, которое сделано в постулате 4. Так электрон может быть составной частью электронной оболочки двух различных атомов и при этом невозможно сказать, что он принадлежит исключительно какому-то одному из атомов. Следовательно, в общем случае невозможно сказать, что один из элементов соединения в ходе химического превращения окислился или восстановился и что другой элемент не претерпел таких изменений; однако ситуация является таковой только когда мы ограничиваемся рассмотрением веществ полностью полярного типа, так что такие отличия становятся все менее и менее неопреленными. Поскольку этот вопрос является одним из тех вопросов, к которому мы будем часто обращаться, нет нужды обсуждать его далее в данный момент. |
| Постулат 5 основан на том факте, что мы не можем определить то, что может быть названо внутриатомными изомерами. Если электроны атомной оболочки могут занимать в определенный момент времени одно положение, а в другой момент – другое положение, и если не существует каких-либо предпочтений для быстрого перехода из одного из этих положений в другое, мы должны иметь большое число изомеров, отличающихся друг от друга только расположением электронов в атомной оболочке. Хотя, возможно, и могут существовать отдельные случаи, где мы могли бы предполагать существование именно таких изомеров, в большинстве случаев, очевидно, что они не существуют, и поэтому мы должны принять значительную свободу в изменении одного распределения электронов в оболочке на другое. |
| Таким образом, имеются только два способа, какими одна частица удерживает другую частицу. Она может, благодаря силам притяжения, притягиваться в направлении к частицы, пока эта сила постепенно не будет компенсирована более быстрым возрастанием сил отталкивания. В этом случае она останавливается в точке, где результат сложения сил притяжения и отталкивания становится равным нулю, и вследствие этого занимает вынужденное положение по отношению к любому перемещению вдоль линии, соединяющей два центра; в том случае, когда расстояние между двумя частицами уменьшается, они отталкиваются друг от друга, а когда расстояние увеличивается – они притягиваются друг к другу. Примером такого типа является тело, притягиваемое к Земле, но покоящееся на эластичном основании, при этом гравитационные силы притяжения уравновешиваются силами отталкивания, которые мы называем силами эластического сопротивления; однако было бы ошибкой считать, что силы эластического сопротивления отличаются по своей природе от других известных сил. На самом деле, очевидно, что также как мы имеем закон всеобщего притяжения между частицами на больших расстояниях, то на малых расстояниях мы имеем такой же универсальный закон отталкивания. |
| Другим способом, каким одно тело может удерживать другое, является способ, благодаря которому планеты удерживаются Солнцем, и это именно тот способ, который в некоторых современных теориях строения атома, как предполагается, ответственен за удержание электронов атомами. Такое предположение представляется неадекватным для объяснения даже простейших химических свойств атома, и, как мне представляется, он был использован только ради поддержания законов электромагнетизма, которые, как известно, действительны на больших расстояниях. Однако факт заключается в том, что в наиболее передовой из этих теорий исчезает даже это сомнительное преимущество, поскольку не выполняются обычные законы электричества. Наиболее интересной и многообещающей из этих теорий является теория, предложенная Бором1, и основанная на квантовой теории Планка. Планк в своем элементарном осцилляторе, который совершает свои колебания при абсолютном нуле, и Бор с его движением электронов по фиксированным орбитам, ввели в рассмотрение системы, содержащие электроны, движение которых не оказывает никакого влияния на внешние заряды. В настоящее время это не только не согласуется с принятыми законами электромагнетизма, но, могу добавить, логически неприемлемы, такое состояния движения, которое не оказывает никакого физического влияния, лучше всего может быть названо состоянием покоя. |
| Действительно, трудно себе представить, что можно добиться существенного прогресса в решении сложных проблем, касающихся химической связи, путем принятия заранее определенных законов сил, действующих между положительными и отрицательными составными частями атома, и затем на основании этих законов построения механической модели атома. Необходимо в первую очередь, исходя из исследований химических явлений, изучить строение и устройство атомов, и если мы найдем необходимым изменить закон силы, действующей между заряженными частицами на малых расстояниях, даже вплоть до смены знака этих сил, а это будет не в первый раз в истории науки, тогда увеличение объема фактического материала потребует изменения обобщений, основанных на меньшем количестве фактического материала. На самом деле, в данном случае, совершенно независимо от каких либо химических причин, исследование математической теории электрона приведет, я уверен в этом, неопровержимо к выводу о том, что закон обратных квадратов Кулона не выполняется на малых расстояниях. |
| В связи с этим я хочу привлечь внимание к чрезвычайно интересной статье А.Л. Парсона, 2 опубликованной буквально на днях, однако которую я имел возможность просмотреть год тому назад вместе с автором. Основным предположением теории Парсона является то, что электрон является не только электрически заряженной частицей, но также маленьким магнитом, или, в его терминологии, магнетоном. Предполагая, таким образом, существование магнитных, а также электрических сил между различными частями атома, Парсон совершенно независимо пришел к выводу, который я привел выше, а именно, что наиболее стабильной конфигурацией электронной оболочки атома является такая, в которой каждый из ее восьми электронов удерживается в вершине куба. |
| 1 Я полагаю, что имеется определенная часть теории Бора, для которой предположение об электронных орбиталях не является необходимым, поскольку их можно интерпретировать непосредственно в рамках существующей теории. Она объясняет спектральные серии водорода исходя из предположения, что электрон может свободно переходить на любую из серии орбит, скорости движения по которым различаются скачкообразно, эти скачки могут быть просто выражены с помощью конечных единиц (в теории Планка такой величиной является h), и что излучение происходит тогда, когда электрон переходит с одной орбитальной скорости движения на другую. Мне кажется значительно проще предположить, что электрон может удерживаться в атоме в стабильном равновесии в определенном числе определенных положений, каждое из которых имеет определенные силы удержания электронов, соответствующие определенной частоте электрона, интервалы между силами удержания электронов в последовательных положениях могут быть просто выражены в терминах конечных рациональных значений (см. Lewis and Adams, Phys. Rev., 3, 92 (1914)). |
| 2 "Магнетонная теория строения атома," Smithsonian Publication 2371, Washington, 1915. |
| Не только в этом, но и во многих других важных моментах теория, представленная мной, совпадает с теорией, изложенной в статье Парсона. Результаты магнитных экспериментов, с помощью которых он предполагает проверить теорию магнетона будут иметь большой интерес. Тем временем мы можем попытаться найти, независимо от любого априорного соображения, какая теория строения атома наилучшим образом объясняет химические факты. |
| Определенная часть теории Парсона, которая согласуется с моей собственной первоначальной теорией, которую, однако я уже считаю неверной. Идея о том, что аргон является системой концентрических кубов (по теории Парсона кубы бок о бок), и что неон является аналогичной системой, имеющей на один куб меньше, естественным образом приводит к предположению, что гелий устроен аналогичным образом. Однако полученные недавно доказательства при исследовании явления радиоактивности, а также из полученных Мозли результатов исследования рентгеновских спектров, позволяют практически определенно считать, что гелий имеет в целом не восемь, а либо два, либо четыре электрона.1 Считая, что гелий является единственным элементом между водородом и литием, и что он обладает двумя электронами, кроме того это очевидно из инертного характера гелия, а также из схожести этого элемента с другими инертными газами, что в данном случае пара электронов играют ту же самую роль, что и группа из восьми электронов у более тяжелых атомов, и что в строке периодической таблицы, состоящей из водорода и гелия, вместо правила восьми электронов мы имеем правило двух электронов. Поэтому водород на своей внешней оболочке имеет один электрон, который может не только переходить на оболочку другого атома, в точности так же, как электрон лития или натрия, но и способен принимать один электрон с образованием стабильной пары, так же, как фтор или хлор принимают электрон с образованием стабильной группы из восьми электронов. Поэтому водород следкет рассматривать как первый член группы галогенов, а также как первый член группы лития. В соответствии с этой точкой зрения гидрид лития является солью2, хотя возможно и менее полярной, чем фторид или хлорид лития. Вследствие чего мы будем рассматривать приобретение одного дополнительного электрона водородом как полностью аналогичное приобретению необходимого числа электронов с образованием октета в случае других атомов. |
| 1Два, если водород и гелий являются единственными элементами с атомным весом, меньшим, чем у лития; четыре, если мы предположим, согласно Ридбергу, что существуют две строки в периодической таблице, одна содержит водород и прото-гелий, а другая содержит эка-водород и гелий. Приведенные выше рассуждения будет тем же самым при любом варианте, и хотя предположение Ридберга имеет высокую степень вероятности, я для простоты использовал более привычную. |
| 2 С целью проверки этой точки зрения, профессором О.Ф. Стаффордом были начаты эксперименты. Эти эксперименты пока далеки от завершения, однако они по меньшей мере показали, что расплавленный гидрид лития является хорошим электролитом. |
Строение молекул. |
| Теперь я попытаюсь показать, как используя единственный тип химического связывания, можно объяснить большое разнообразие химических изменений. В соответствии с первоначальным предположением Гельмгольца, которое использовалось некоторыми авторами под именем электронной теории валентности, и в соответствии с которой каждый электрон либо полностью переходит, либо не переходит от одного атома к другому, можно дать достаточно удовлетворительное объяснение соединениям, которые явным образом относятся к полярному типу, однако этот метод становится менее удовлетворительным, когда мы подходим к неполярному типу. Более чем разница между типичными полярными и неполярными веществами, можно показать, каким образом молекула может, в соответствии со своим окружением, превращаться из крайне полярной в крайне неполярную форму, не per saltum (одномоментно), а в результате незаметных градаций, как только мы допустим, что электрон может быть в совместном владении двух атомных оболочек. |
| Рассмотрим вначале очень полярные соединения. В данном случае мы обнаруживаем элементы с небольшим числом электронов на своих оболочках, стремящихся отдать все эти электроны с образованием положительных ионов, и элементы, которые уже обладают определенным числом электронов и стремящихся увеличить их число до восьми. Так например, Na+ и Ca++ являются ядрами без оболочек, тогда как хлорид-ион, сульфид-ион, нитрид-ион (как в расплавленных нитридах) могут быть представлены в виде атомов, обладающих на своих оболочках восемь электронов – в углах куба. |
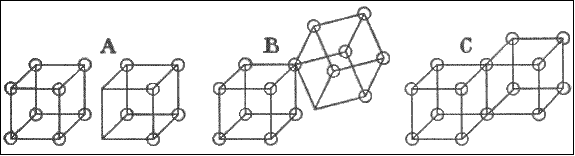
| В качестве введения в изучение веществ слабо полярного типа можно рассмотреть галогены. На рисунке 3 я попытался показать различные формы молекулы иода I2. |
|
| «A» представляет молекулу как полностью ионизированнную, как это несомненно в определенной степени имеет место в жидком иоде1. Без ионизации мы можем иметь только такую ситуацию, что один из электронов одного из атомов внедряется во внешнюю оболочку второго атома, завершая его оболочку до октета как в форме «B». Однако в то же самое время электрон второго атома может внедриться в оболочку первого, тем самым дополняя до октета оболочки обоих атомов с образованием формы «C», которая является преобладающей и характерной структурой галогеном. Теперь, несмотря на симметрию формы «C», если два атома, по каким либо причинам, стремятся отделиться, два общих электрона могут иногда удерживаться более прочно иногда к одному из атомов, иногда к другому, образуя таким образом некоторую диссимметрию в молекуле как целом, и один атом будет иметь небольшой избыток положительного заряда, а другой - отрицательного. |
| 1 См. Льюис и Вилер, Loc. cit. |
| Это разделение зарядов и последовательное усиление полярного характера молекулы будет увеличиваться по мере разъединения атомов на большее расстояние пока не произойдет полная ионизация.1 Так между полностью симметричной и неполярной молекулой «C» и полностью полярной и ионизированной молекулой, представленной с помощью «A», будет находиться бесконечное множество промежуточных состояний, обладающих большей или меньшей степенью полярности. Теперь в веществе, подобном жидкому иоду, не следует считать, что все молекулы находятся в одном и том же состоянии, скорее ситуация такова, что некоторые из них являются высоко полярными, некоторые – практически неполярны, а другие представляют собой все градации между этими двумя. Когда мы обнаруживаем, что иод в различных условиях показывает различные степени полярности, это означает только то, что в одной из сред наблюдается более высокая доля более полярных форм. Так бром, хотя его строение и представляется полностью аналогичной формулой, менее полярен, чем иод. Другими словами, в средней молекуле разделение зарядов меньше, чем в случае иода. Хлор и фтор еще менее полярны и могут рассматриваться как соединения, практически полностью состоящие из молекул в форме «C». |
| Я хочу еще раз подчеркнуть тот смысл, который должен быть приписан термину таутомерии. В простейшем случае, когда мы имеем дело с единственным таутомерным превращением, мы говорим о двух таутомерах и иногда записываем определенные формулы для выражения их строения. Однако не следует предполагать, что все молекулы вещества обладают либо одним, либо другим строением, а скорее, что эти формы представляют два предельных типа, и что индивидуальные молекулы заполняют весь промежуток между этими предельными формами. В определенных случаях, когда большинство молекул находятся в состоянии, расположенном очень близко к одному предельном состоянию или к другому, весьма удобно и желательно попытаться выразить в процентах доли молекул, принадлежащих к одной или другой таутомерной форме; однако в том случае, когда большинство молекул расположены в промежуточном диапазоне и относительно небольшое их число - в непосредственной близости к двум предельным формам, такие расчеты теряют большую часть своей значимости. |
| В случае галогенов, дело случая какой из атомов приобретает положительный, а какой - отрицательный заряд, однако в случае бинарных соединений, составленных из различных элементов атомы одного элемента в молекулах будут в большинстве случаев положительными, хотя и не обязательно все из них. Так, в Br2 атомы брома одинаково часто положительны, столь и отрицательны, однако в BrCl он обычно положителен, а в IBr обычно отрицателен, хотя во всех этих веществах, которые не очень полярны, разделение зарядов в молекуле будет незначительно, в то время как в галогенидах металлов разделение зарядов практически полное, и атомы галогена приобретают электроны практически полностью в свое распоряжение. Для того чтобы с помощью символов выразить эту идею химического объединения, я предложил использовать двоеточие, или две точки, расположенные несколько иным способом, для представления двух электронов двух электронов, которые выполняют роль связи между двумя атомами. |
| 1 Если процесс расщепления происходит в неполярном окружении, атомы могут разделяться таким образом, что каждый получает по одному из двух общих электронов, как при термической диссоциации газообразного иода. |
| Таким образом, мы можем написать Cl2 как Cl : Cl. Если в некоторых случаях нам необходимо показать, что один из атомов молекулы в среднем заряжен отрицательно, мы можем сдвинуть двоеточие ближе к отрицательному элементу. Так, мы можем написать Na :I, и I :Cl. Различное расположение пробела для представления различной степени полярности, естественно, можно свободно использовать как на доске, так и при печати. |
| Необходимо отметить, что поскольку в периоде водород - гелий мы имеем правило двух электронов, вместо правила октета электронов, введение одного электрона в оболочку водородного атома полностью аналогично завершению куба в случае галогенов. Таким образом, мы можем рассматривать обычный водород как гидрид положительно заряженного иона водорода, в том же смысле, что хлор можно рассматривать как хлорид положительно заряженного атома хлора. Однако H, значительно менее полярен даже чем Cl2. Три основных типа соединений водорода, следовательно, может быть представлены следующими формулами H :Cl, H : H и Na -:H. |
| Мы можем пойти еще дальше и привести полные формулы для каждого соединения, используя символ ядра вместо обычного символа атома с присоединением к каждому символу числа точек, соответствующего числу электронов в оболочке атома. Таким образом, мы можем написать |
|
| однако мы увидим, что в большом числе случаев такие формулы представляют только одну из многочисленных предельных таутомерных форм. В целях упрощения мы можем также время от времени использовать формулы, которые показывают только те электроны, которые имеют отношение к объединению двух атомов, как в предыдущих параграфах. |
|
| Очевидно, что типы объединений, которые we изображали до сих пор, хотя и содержат в себе два электрона, удерживаемые совместно двумя атомами, тем не менее принадлежат к одинарной связи, как это обычно делается в графических формулах. Для того чтобы дополнительно проиллюстрировать этот момент, мы можем обсудить вопрос, который оказался чрезвычайно затруднительным для целого ряда теорий валентности. Я ссылаюсь на строение аммиака и иона аммония. Ион аммония, естественно, за счет крайне полярного характера аммиака и иона водорода, может рассматриваться как свободный комплекс, образовавшийся в результате электрического притяжения двух полярных молекул. Однако, когда мы рассмотрим эффект замещения атомов водорода на органические группы, мы постепенно приходим к такому состоянию, в котором мы можем быть полностью уверенными в том, что все четыре группы присоединены непосредственно к атому азота, и все эти группы удерживаются настолько просто, что становиться возможным получение многочисленных стереохимических изомеров. Решение этой проблемы в рамках представленной здесь теории является чрезвычайно простым и удовлетворительным, достаточно написать уравнение с помощью новых символов, чтобы сделать объяснение очевидным. Так например, для NH3 + H+ = NH4+ можно написать |
|
| Когда ион аммония соединяется с хлорид-ионом последний не присоединяется непосредственно к атому азота, а просто удерживается посредством электрических сил ионом аммония. |
| Поскольку две точки в наших формулах соответствуют линии, которая используется для представления одинарной связи, мы приходим в результате их использования к определенным большой важности, которые, как я предполагаю, не встречались никому, кто использует обычные символы. Так, обычно принимается, что атом двухвалентного элемента должен быть связан двумя связями с другим элементом или элементами, или остаться с «ненасыщенной валентностью». С другой стороны, теперь мы можем написать формулы, в которых атом кислорода связан только одной парой электронов с другим атомом и тем не менее каждый элемент в соединении будет полностью насыщенным. Для иллюстрации этого важного момента мы можем написать формулы перхлоратов, сульфатов, ортофосфатов и ортосиликатов, в которых каждый атом имеет заполненную оболочку из восьми электронов. |
|
| Таким образом представляются формулы всех этих ионов. Если X является хлором, ион имеет один отрицательный заряд; если серой, то ион имеет два отрицательных заряда, и так далее. Объединение триоксида серы с оксид-ионом с образованием сульфат-аиона аналогично присоединению водорода к аммиаку с образованием иона аммония. Кислоты или ионы кислот образуются из упомянутых выше ионов в результате присоединения иона водорода; или H, к атомам кислорода. |
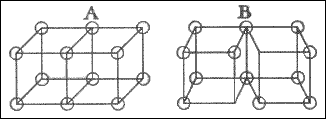
| Далее можно рассмотреть двойную связь, в которой четыре электрона удерживаются совместно двумя атомами. Так рис. 4, A представляет типичную структуру молекулы кислорода. Характерным свойством двойных связей является их стремление к «разрыву». Когда это происходит симметричным образом, за исключением случаев очень полярного окружения, это приводит к появлению двух соответствующих атомов в нечетном состоянии, каждый с неспаренным электроном в оболочке. До тех пор пока вещество с двойной связью принимает эту другую таутомерную форму, оно будет демонстрировать все свойства веществ с четными молекулами. Так на рисунке 4, B представлена эта таутомерная форма молекулы кислорода; равновесие между формами «A» и «B» полностью аналогично равновесию между N2O4 и NO2. При низких температурах почти каждый известный случай соединения с кислородом вначале дает пероксид. Это показывает, что кислород существует в заметной степени в форме, которая представляется формой B, в которой она может присоединяться непосредственно к другим атомам в точности как этилен образует соединения присоединения. Эти две формы кислорода (которые, естественно, могут переходить одна в другую в результате непрерывных градаций) могут быть представлены как |
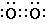 и 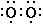 и две формы этилена 1 как 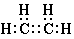 и 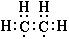 . |
| Теперь следует обсудить нестабильность кратных связей и принципы, лежащие в основе теории напряжений Байера, однако прежде чем перейти далее в этом направлении, важно рассмотреть общие взаимосвязи между силой удержания электронов атомами, которые удерживает вместе все атомы молекулы, и стабильностью молекулы. Термин «стабильность» используется в двух весьма различных смыслах, в соответствии с тем, о чем идет речь: о склонности реакции к протеканию или о скорости этой реакции. Мы говорим об оксиде азота как о чрезвычайно устойчивом веществе, хотя оно является термодинамически нестабильным, и свободная энергия, вовлекаемая в его разложение огромна, однако он настолько инертен, что не претерпевает никаких ощутимых изменений. Высокая степень инертности обычно означает наличие очень жестких сил удерживания электронов, действующих внутри молекулы, однако эти мощные силы могут действовать только на очень малых расстояниях, так что работа, затрачиваемая на их преодоление, может быть очень мала. Для того чтобы проиллюстрировать этот момент, рассмотрим частицу железа, притянутую магнитом. Она притягивается вниз силами гравитации и вверх - магнитным полем, и хотя суммарная работа, получаемая при отделении ее от магнита и позволяющая ей упасть на землю может быть положительной, она, тем не менее, не падает сама по себе, а может быть отделена от магнита под действием силы, значительно большей, чем сила гравитации. То же самое наблюдается и в случае молекулы, термодинамическая стабильность можно ассоциировать с работой разрыва какой либо связи, однако инертность молекулы зависит от силы, которая необходима для разрыва этой связи. |
| Прежде чем рассматривать тройные связи, для которых кубическая структура не дает простого представления, я хотел бы обсудить некоторые идеи, недавнему развитию которых я весьма обязан предложениям, сделанным доктором Л Розенштайном, доктором Е.К. Адамсом и господином Ф.Р. фон Бичовски, а также работе господина А.Л. Парсона, на которого я уже ссылался. В моей первоначальной теории куб был основной структурой всех атомных оболочек. Однако мы увидели, в случае элементов с атомными весами, меньшими, чем у лития, что пара электронов образует стабильную группу, и мы можем задаться вопросом, не может ли, в общем, пара электронов, а не октет, рассматриваться в качестве основной единицы. |
| 1 Я отложу обсуждение важного аспекта таких формул до обсуждения вопроса о сопряженных двойных связях. |
| Возможно, главными причинами для принятия кубического строения было то, что куб является наиболее симметричным расположением октета электронов, и при таком расположении электроны расположены на наибольшем расстоянии друг от друга. На самом деле по сути дела представляется возможным, что в элементах с большими атомными оболочками (с большим атомным объемом) электроны расположены достаточно далеко друг от друга, и закон Кулона обратных квадратов в первом приближении оказывается действительным, и в таких случаях вполне вероятно, что взаимное отталкивание восьми электронов будет способствовать реализации кубической структуры. |
| Впрочем, это является определенно априорными умозаключениями, которые мы решили не применять в настоящей статье, и если мы будем рассматривать только известные химические явления и их наилучшие объяснения в терминах строения атома, мы придем к принятию несколько иного расположения октета электронов, по меньшей мере в случае более неполярных соединений, молекулы которых, как правило, состоят из атомов малого атомного объема. |
| Природа такого расположения показана на рис. 5. Кубическое представление электронного строения, которое мы принимали до настоящего времени для атома углерода, связанного с четырьмя другими атомами, которые не показаны на рисунке, но каждый из которых присоединен к атому углерода парой электронов. Эти пары отмечены тем, что соединены жирной линией. Принимая идею, по меньшей мере в таких очень маленьких атомах как атомы углерода, что электроны в каждой паре стремятся к взаимному притяжению, возможно, за счет магнитных сил, если верна теория магнетона, или возможно за счет других сил, которые становятся заметными на коротких расстояниях, и занять положения, отмеченные пунктирными кружками, мы получаем модель, которая прекрасно подходит для отображения всех характеристик атома углерода. С помощью кубической структуры невозможно не только представить образование тройной связи, но и объяснить явление свободного вращения вокруг простой связи, которое всегда необходимо учитывать в стереохимии. С другой стороны, группа из восьми электронов, в которой пары электронов расположены симметрично вокруг центра дает соответственно модель тетраэдрического атома углерода, которая имеет столь большое значение во всей органической химии. |
| Как обычно, два тетраэдра, связанные одним, двумя или тремя углами, представляют соответственно, одинарную, двойную и тройную связи. В первом случае одна пара электронов удерживаются совместно двумя атомами, во втором случае - две такие пары, и в третьем случае - три пары. |
Тройная связь представляет собой наивысшую возможную степень связывания двух атомов. Подобно двойной связи в ней может быть разорвана одна связь с образованием двух нечетных атомов углерода, однако она может порвать также и другим способом, которым не может порваться двойная связь, а именно, оставляя одинарную связь и два (двухвалентных) атома углерода, каждый из которых имеет пару электронов, которая не связана ни с каким другим атомом. Три таутомерные формы могут быть представлены в случае ацетилена 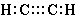 , , 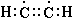 и и 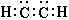 . Кроме того, мы имеем форму, соответствующую ацетилидену Нефа и такую форму, какая может существовать в сильно полярной среде, такая как ацетиленид анион . Кроме того, мы имеем форму, соответствующую ацетилидену Нефа и такую форму, какая может существовать в сильно полярной среде, такая как ацетиленид анион 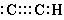 . . |
| Нестабильность кратных связей, а также общее явление образования циклов в органических соединениях прекрасно объясняются в рамках теории напряжений Байера. Эта теория однако может быть представлена в более общей форме, если сделать простое предположение, что все ядра атомов отталкиваются друг от друга, и что молекулы удерживаются вместе только парами электронов, которые совместно удерживаются составными частями атомов. Таким образом, два атома углерода, связанные одинарной связью, стремятся удерживать свои ядра настолько далеко друг от друга, насколько это только возможно, и это условие удовлетворяется в том случае, если прилегающие ядра двух тетраэдров лежат на линии, соединяющей центры тетраэдров. Это является основным моментом теории образования циклов Байера. Когда одинарная связь становится двойной, и атомные оболочки имеют в совместном владении две пары электронов, ядра вынуждены располагаться ближе друг к другу, и взаимное отталкивание этих ядер существенным образом ослабляет удерживание электронов в точках сочленения тетраэдров. Это уменьшение сил удерживания электронов, следовательно, дает значительный эффект в увеличении подвижности электронов. В любой части углеродной цепи, где некоторое число последовательно связанных атомов связано двойными связями, во всей этой части молекулы наблюдается чрезвычайная реакционная способность и свобода перегруппировок. Эта свобода обычно заканчивается в той точке цепи, где атом имеет только одинарные связи, и в которой, следовательно, электроны удерживаются более жесткими силами, хотя должно было бы наблюдаться, что увеличенная подвижность электронов (и, следовательно, повышенная полярность) в одной части молекулы всегда дает некоторое увеличение подвижности в соседних частях. |
| Обратимся теперь к проблеме, в решении которой теория, которую я представил, демонстрирует свою наибольшую полезность. Электрохимические теории Дэви и Берцилиуса были заслонены теорией «валентности», когда внимание химиков было в основном привлечено к неполярным веществам органической химии. Позже электрохимические теории еще раз становились преобладающими, однако в этом вопросе всегда существовал антагонизм между двумя точками зрения, который неизменно возникает, когда две соперничающие теории являются взаимоисключающими, хотя обе содержат определенные элементы истины. Действительно, теперь можно видеть, что с помощью трактовки, которую мы сейчас используем, эти две теории могут и не быть взаимоисключающими, а скорее дополняющими друг друга, поскольку теория «валентности», которая является классическим основанием структурной органической химии, имеет дело с фундаментальным строением молекулы, в то время как электрохимическое рассмотрение показывает влияние положительно и отрицательно заряженных групп при небольших искажениях основной формы. Примем окончательно, что под отрицательным элементом или радикалом подразумеваем тот, который стремиться оттянуть на себя электронную пару, которая входит в состав внешних оболочек всех соседних атомов, и что электроположительной группой является группа, которая в меньшей степени притягивает электроны, или отталкивает их. В большинстве соединений углерода можно наблюдать лишь очень незначительное такое разделение зарядов, которое придает соединению полярный характер, хотя определенные группы, такие как гидроксил, а также группы, содержащие кратные связи, не только сами по себе обладают ярко выраженным полярным характером, но и усиливают, в соответствии с изложенными выше принципами, полярный характер всех соседних частей молекулы. Однако в таких молекулах как метан и четыреххлористый углерод, вместо того, чтобы предполагать, как в некоторых современных теориях, что эти четыре электрона явным образом смещаются от водорода к углероду в первом случае, и от углерода к хлору во втором, мы можем полагать, что в метане наблюдается небольшое смещение заряда в сторону атома углерода, в результате чего углерод в небольшой степени заряжен отрицательно, и что в тетрахлориде углерода они слегка сдвинуты в сторону хлора, что придает атому углерода небольшой положительный заряд. Необходимо помнить, что в данном случае мы имеем дело со средними значениями и что в небольшом числе от основного числа молекул метана атомы водорода могут быть заряжены отрицательно, а атом углерода - положительно. |
| В веществах подобных воде электроны смещены от водорода к кислороду и в предельном случае мы имеем определенное число атомов водорода, которые полностью отщепились в виде ионов водорода. Количество отщеплений одного из атомов водорода, и тем самым степень ионизации, сильно изменится, если другой атом водорода будет заменен на положительную или отрицательную группу. В качестве знакомого примера можно рассмотреть уксусную кислоту, в которой один атом водорода заменен на атом хлора, H2ClC-COOH. Электроны, оттягиваемые хлором, позволяют паре электронов, связывающей метильную и карбоксильную группы, ближе подойти к атому углерода метильной группы. Эта пара электронов, поэтому в меньшей степени отталкивает другие электроны гидроксильного атома кислорода, позволяя им также сдвигаться в том же направлении. Другими словами, все электроны смещаются влево, создавая большее отделение электронов от атома водорода гидроксильной группы, давая тем самым более сильную кислоту. Это простое объяснение применимо к большому числу отдельных случаев. Необходимо только иметь в виду, что хотя эффект такого перемещения электронов к одному из концов цепи происходит вдоль всей цепи, он становится все менее выраженным с увеличением расстояния 1, и с увеличением прочности связей, которые удерживают электроны в пространстве между атомами. |
| 1 Под расстоянием понимается фактическое расстояние. Так если цепочка из пяти или шести связей принимает кольцеобразную форму, эти два конца имеют большее влияние друг на друга, на что в многочисленных случаях указывал Михаэль. |
| Столь подробное рассмотрение теории строения атомов и молекул может быть дополнено практически бесконечным числом примеров ее применения к многочисленным типам соединений, однако я полагаю, что сказал достаточно, как с помощью простой гипотезы мы можем объяснить большинство различных типов химических связей и как мы можем построить модели, которые бы иллюстрировали непрерывный переход от исключительно полярных к исключительно неполярным веществам. Поэтому я хотел бы завершить настоящую статью подробным обсуждением явления, которое тесно связано с идеями, которые здесь были представлены. |
Цвет химических соединений. |
| Июль 28, 1997 - эта часть будет представлена в будущем. |
| |
| |
| |
| |
| |
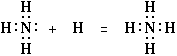
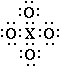
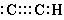 .
.